题目内容
2.NA代表阿伏加德罗常数的值,下列叙述正确的是( )| A. | 1mol Na2O2与足量的水反应,转移的电子数为2NA | |
| B. | 17g羟基中含有的电子数为10NA | |
| C. | 标准状况下,1mol已烷中共价键数目为19NA | |
| D. | 1L 0.10mol•L-1的Na2CO3溶液中阴离子数目之和小于0.1NA |
分析 A.过氧化钠与水反应为歧化反应,过氧化钠中-1价的氧,部分化合价升高,部分化合价降低;
B.1个羟基含有9个电子;
C.1个己烷分子中含有,5个C-C键,14个C-H键;
D.CO32-的水解导致阴离子数目增多.
解答 解:A.1molNa2O2与水反应生成氧气,由O元素的化合价从-1价升高为0可知,每反应1molNa2O2转移1mol电子,故A错误;
B.17g羟基物质的量为$\frac{17g}{17g/mol}$=1mol,含有的电子数为9NA,故B错误;
C.1个己烷分子中含有,5个C-C键,14个C-H键,则1mol已烷中共价键数目为19NA,故C正确;
D.CO32-的为多元弱酸酸根离子,水解导致阴离子数目增多,1L 0.10mol•L-1的Na2CO3溶液中阴离子数目之和大于0.1NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的应用,熟悉以物质的量为核心的计算公式的解题关键,注意己烷结构特点、盐类水解规律,题目难度不大.

练习册系列答案
 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
2.下列说法不正确的是( )
| A. | 某试样焰色反应呈黄色,则试样中一定含有Na+ | |
| B. | 精密pH试纸测得某碱性溶液的pH为12.5 | |
| C. | 容量瓶不能用作溶解物质的容器 | |
| D. | 粗盐的提纯试验中,滤液在蒸发皿中加热蒸发结晶 |
13.下列说法正确的是( )
| A. | 明矾具有杀菌消毒作用,可用于净水 | |
| B. | 烧碱不是碱、石炭酸不是酸、双氧水不是水 | |
| C. | 电解质在水溶液中的反应都是离子反应 | |
| D. | 我国首创的新型抗疟疾药青蒿素(C15H22O5)属于氧化物 |
17.已知某+2价离子的电子排布式为1s22s22p43s23p43d10,该元素在周期表中所属的族是( )
| A. | ⅡA | B. | ⅡB | C. | ⅤⅡ | D. | ⅠB |
7.在Na2SO3溶液中存在的下列关系不正确的是( )
| A. | c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3) | B. | c(Na+)+c(H+)=c(OH-)+c(SO32-)+c(HSO3-) | ||
| C. | c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3) | D. | c(Na+)>c(SO32-)>c(OH-)>c(HSO3-) |
14.在FeCl3和CuCl2混合液中,加入过量的铁粉,充分反应后,溶液中的金属离子是( )
| A. | Fe2+和 Fe3+ | B. | Fe2+ | C. | Cu2+ 和Fe2+ | D. | Cu2+ |
11.下列各组离子,能在溶液中大量共存的是( )
| A. | Ca2+Cl- CO32- | B. | Na+ Ba2+ Cl- | ||
| C. | Na+ SO42- Ba2+ | D. | H+ NO3- OH- |
12. HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:
HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:
(1)浓度不同HNO3氧化性不同,试举一例说明浓硝酸能与碳反应,而稀硝酸不能.
(2)HNO3能氧化多种金属.金属活动顺序中,Ag以前的金属都能与HNO3反应,但常温下Fe、Al(填元素符号)在浓HNO3中能钝化.
(3)盐酸对HNO3氧化性有影响.浓硝酸与浓盐酸按1:3体积比混合所得混合液称王水,具有强氧化性.金溶于王水产生遇空气变色的气体,金转化为易溶性强酸H[AuCl4].请写出其离子方程式:Au+4H++NO3-+4Cl-=NO↑+AuCl4-+2H2O.
(4)与金属反应的过程中,HNO3能被还原成多种含氮产物,如:NO2、HNO2、NO、N2O、N2、NH2OH、NH4+(或硝酸铵NH4NO3).
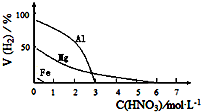
(5)HNO3是一种强酸,与活泼金属反应时,HNO3的还原产物中可能存在H2,某兴趣小组设计实验,探究金属与稀HNO3反应制取H2的影响因素,其结果如图所示.
该兴趣小组设计以下实验,探究金属与HNO3反应产生H2的影响因素可供选择的试剂:Fe粉、Mg粉,HNO3(0.1mol•L-1、2.0mol•L-1)
有同学认为,金属与HNO3反应是放热反应,温度也会影响金属与HNO3反应产生H2,反应器需要置于冷水浴中保持常温.
 HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:
HNO3是一种氧化性的强酸,与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:(1)浓度不同HNO3氧化性不同,试举一例说明浓硝酸能与碳反应,而稀硝酸不能.
(2)HNO3能氧化多种金属.金属活动顺序中,Ag以前的金属都能与HNO3反应,但常温下Fe、Al(填元素符号)在浓HNO3中能钝化.
(3)盐酸对HNO3氧化性有影响.浓硝酸与浓盐酸按1:3体积比混合所得混合液称王水,具有强氧化性.金溶于王水产生遇空气变色的气体,金转化为易溶性强酸H[AuCl4].请写出其离子方程式:Au+4H++NO3-+4Cl-=NO↑+AuCl4-+2H2O.
(4)与金属反应的过程中,HNO3能被还原成多种含氮产物,如:NO2、HNO2、NO、N2O、N2、NH2OH、NH4+(或硝酸铵NH4NO3).
(5)HNO3是一种强酸,与活泼金属反应时,HNO3的还原产物中可能存在H2,某兴趣小组设计实验,探究金属与稀HNO3反应制取H2的影响因素,其结果如图所示.
该兴趣小组设计以下实验,探究金属与HNO3反应产生H2的影响因素可供选择的试剂:Fe粉、Mg粉,HNO3(0.1mol•L-1、2.0mol•L-1)
| 影响因素 | 实验步骤 | 实验结论 |
| 金属的种类 | 两只烧瓶中各放入5g颗粒大小大致相同的Fe粉、Mg粉,分别加入2mol•L-1 HNO3溶液50mL,反应结束后,用气体分析仪测定气体中H2的体积分数 | 在该浓度的稀HNO3中,Mg能反应, Fe粉不反应, |
| 硝酸的浓度 | 两只烧瓶中各放入5g颗粒大小大致相同的Mg粉,分别加入0.1mol•L-1HNO3、2.0mol•L-1HNO3,反应结束后,用气体分析仪测定气体中H2的体积分数 | 硝酸浓度越稀,产生氢气越多. |
 .
. .
.