题目内容
10.有关物质的转化关系如图所示(部分物质和条件已略去).A是常见金属单质;B、C、D、H常温下是气态,其中D呈红棕色,F、G是常见强酸,E是最常见的无色液体,I的组成元素与E相同,J的溶液呈蓝色.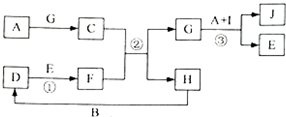
(1)D的化学式为NO2.I的电子式为
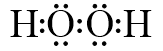 .
.(2)若有1molD参加反应①,反应中转移的电子数为$\frac{2}{3}$mol.
(3)反应②的离子方程式为2NO3-+3SO2+2H2O=3SO42-+2NO+4H+.
(4)写出反应③的化学方程式,并用单线桥标出电子转移的方向和数目
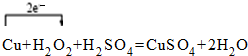 .
. (5)反应③开始后,其化学反应速率突然增大,原因是c.
a、该反应为吸热反应
b、物质G的浓度增大
c、反应产物作催化剂
(6)从J的水溶液中获得含结晶水晶体的操作是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
分析 A是常见金属单质;B、C、D、H常温下是气态,其中D呈红棕色,则D是NO2,NO和氧气反应生成二氧化氮,E是最常见的无色液体,能和二氧化氮反应,则E是H2O,F是常见强酸,则F是HNO3,J溶液呈蓝色,说明含有铜离子,则A是Cu,G是强酸,则G为H2SO4,C和F反应生成硫酸和NO,则C是SO2、H是NO、B是O2,I的组成元素与E相同,则I为H2O2,J为CuSO4,
再结合题目分析解答.
解答 解:A是常见金属单质;B、C、D、H常温下是气态,其中D呈红棕色,则D是NO2,NO和氧气反应生成二氧化氮,E是最常见的无色液体,能和二氧化氮反应,则E是H2O,F是常见强酸,则F是HNO3,J溶液呈蓝色,说明含有铜离子,则A是Cu,G是强酸,则G为H2SO4,C和F反应生成硫酸和NO,则C是SO2、H是NO、B是O2,I的组成元素与E相同,则I为H2O2,J为CuSO4,
(1)通过以上分析知,D为NO2,I为双氧水,其电子式为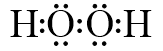 ,
,
故答案为:NO2;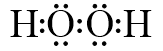 ;
;
(2)二氧化氮和水反应方程式为H2O+3NO2=2HNO3+NO,作氧化剂和还原剂的二氧化氮的物质的量之比为1:2,所以若有1molD参加反应①,反应中转移的电子数为$\frac{2}{3}$mol,故答案为:$\frac{2}{3}$mol;
(3)反应②的离子方程式为2NO3-+3SO2+2H2O=3SO42-+2NO+4H+,故答案为:2NO3-+3SO2+2H2O=3SO42-+2NO+4H+;
(4)反应③的化学方程式Cu+H2O2+H2SO4=CuSO4+2H2O,该反应中转移电子为2,单线桥标出电子转移的方向和数目为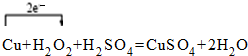 ,
,
故答案为: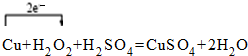 ;
;
(5)反应③中生成铜离子,铜离子对该反应有催化作用,故选c;
(6)从溶液中获取晶体采用蒸发浓缩、冷却结晶、过滤的方法,故答案为:冷却结晶、过滤.
点评 本题考查无机物推断,为高频考点,侧重考查学生分析推断及对元素化合物的掌握,涉及物质推断、氧化还原反应、物质分离、化学用语等知识点,正确推断物质是解本题关键,题目难度中等.

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案①乙烯的最简式:C2H4
②乙醇的结构简式:C2H6O
③乙烷的结构式:CH3CH3
④四氯化碳的电子式:

⑤乙醛的结构简式:CH3COH.
| A. | 全对 | B. | 全错 | C. | ③④ | D. | ①⑤ |
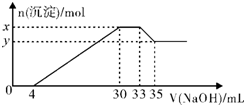
| A. | 原溶液的pH=l | B. | 原溶液中n(Mg2+):n(Al3+)=5:2 | ||
| C. | x与y的差值为0.01mol | D. | 原溶液中c(Cl-)=0.825mol/L |
| A. | 能用作汽车燃料 | B. | 能腐蚀铁制容器 | ||
| C. | 能与NaOH溶液反应 | D. | 能被Cu催化氧化成C02 |
| A. | 乙烯容易与溴的四氯化碳溶液发生反应,且1mol乙烯完全加成消耗1mol溴单质,证明乙烯分子里含有一个碳碳双键 | |
| B. | 苯分子的结构中存在碳碳单键和碳碳双键交替出现的结构 | |
| C. | 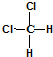 和 和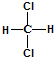 属于同一种物质,不能用来解释甲烷是一种正四面体结构 属于同一种物质,不能用来解释甲烷是一种正四面体结构 | |
| D. | 1mol CH3CH2OH与Na完全反应只生成0.5mol H2,不能说明乙醇分子中有一个氢原子与其它氢原子不同 |
| A. | 1mol Na2O2与足量的水反应,转移的电子数为2NA | |
| B. | 17g羟基中含有的电子数为10NA | |
| C. | 标准状况下,1mol已烷中共价键数目为19NA | |
| D. | 1L 0.10mol•L-1的Na2CO3溶液中阴离子数目之和小于0.1NA |
 则该烃的结构式可能有( )
则该烃的结构式可能有( )| A. | 1种 | B. | 3种 | C. | 2种 | D. | 4种 |
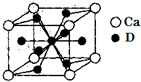 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题: