题目内容
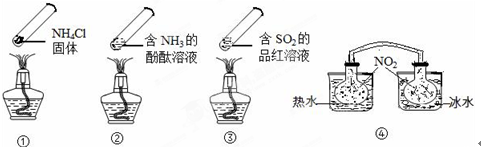
关于下列各装置图的叙述中,不正确的是 ( )
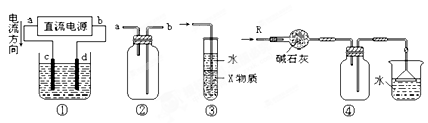

| A.装置①中,d为阴极、c为阳极 |
| B.装置②可用于收集H2、NH3、CO2、Cl2、N2、、HCl、NO2等气体 |
| C.装置③中X若为CCl4,可用于吸收NH3或HCl,(NH3和HCl不溶于CCl4)并可防止倒吸 |
| D.装置④可用于干燥、收集NH3,并吸收多余的NH3 |
B
略

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
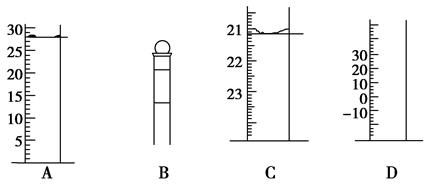
 mL(保留一位小数);
mL(保留一位小数); 低”或“不变”)。
低”或“不变”)。
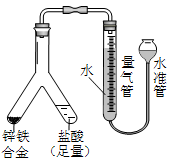
 ②若称得锌铁合金的质量为0.117g,量气管中初读数为1. 00mL,末读数为45.80mL,则合金中铁的含量为________%(保留2位小数,气体读数已折算成标准状况下的数值)。
②若称得锌铁合金的质量为0.117g,量气管中初读数为1. 00mL,末读数为45.80mL,则合金中铁的含量为________%(保留2位小数,气体读数已折算成标准状况下的数值)。 的实验并回答相关问题。
的实验并回答相关问题。 除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下。静置,读取数据并记录为NaOH标准溶液体积的初读数。
除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下。静置,读取数据并记录为NaOH标准溶液体积的初读数。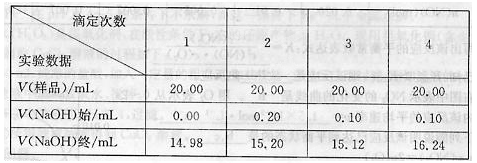

 分液
分液