题目内容
3.海水中含有丰富的人体不可缺少的碘元素,它以碘离子的形式存在.某学生为探究海带中碘元素的存在,按如图流程进行了实验:
回答下列问题:
(1)A步骤的操作名称是过滤;A步骤用到的主要玻璃仪器是a(选填下列字母代号)
a.漏斗 b.分液漏斗 c.量筒 d.蒸发皿
(2)B步骤中加入的试剂是淀粉溶液.
(3)通入Cl2时反应的离子方程式为Cl2+2KI=2KCl+I2,其中氧化剂是Cl2.
(4)下列试剂,可用来萃取碘水中的碘的有:B、D(填字母代号)
A.酒精 B.苯 C.水 D.四氯化碳.
分析 海带灼烧可生成水和二氧化碳,海带灰中含有碘化钾等物质,溶于水,浸泡过滤得到含有碘离子的溶液,加入氯水或通入氯气,氯气置换出碘,得到碘的水溶液,用四氯化碳或苯萃取得到含碘的有机溶液,经蒸馏可得到碘,
(1)依据提取流程分析海带灰悬浊液可以用过滤的方法得到溶液除去不溶性杂质;用到的玻璃仪器有漏斗、烧杯、玻璃棒;
(2)依据转化关系可知溶液1通入氯气把碘离子氧化为碘单质,加入B变蓝证明加入的是淀粉;
(3)依据分析可知,溶液1的阴离子是I-,通入氯气会和碘离子发生氧化还原反应;
(4)根据萃取操作中,萃取剂不能与原溶液相溶,萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,而酒精与水溶液互溶分析.
解答 解:(1)依据提取流程分析海带灰悬浊液可以用过滤的方法得到溶液,除去不溶性杂质;用到的玻璃仪器有漏斗、烧杯、玻璃棒,
故答案为:过滤,a;
(2)淀粉与碘单质反应生成蓝色,依据转化关系可知溶液1通入氯气把碘离子氧化为碘单质,加入B变蓝证明加入的是淀粉,
故答案为:淀粉溶液;
(3)依据分析可知,溶液中含有碘离子,通入氯气会和碘离子发生氧化还原反应;反应的离子方程式为:Cl2+2I-=2Cl-+I2 ,氧化剂是化合价降低的氯元素,所以氧化剂是Cl2,
故答案为:Cl2+2KI=2KCl+I2 ;Cl2;
(4)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,故可用汽油、四氯化碳或苯,酒精与水溶液互溶,溶液不分层,无法用于分液操作分离碘单质,所以B、D符合条件,
故答案为:B、D.
点评 本题考查物质的分离和提纯,学习中注意掌握过滤、萃取、蒸馏等操作,掌握基础是解题关键,题目难度中等.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
14.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4 LCCl4含有的分子数为NA个 | |
| B. | 500mL 1moL/L的盐酸溶液中含有的HCl分子数为0.5 NA个 | |
| C. | 将1L 2 mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA个 | |
| D. | 23gNa与O2反应生成Na2O和Na2O2的混合物,转移的电子数为 NA个 |
11.下列离子方程式书写正确的是( )
| A. | 硫酸亚铁溶液中加过氧化氢溶液 Fe2++2H2O2+4H+═Fe3++4H2O | |
| B. | NaHSO4溶液与Ba(OH)2溶液混合后显酸性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | NaHCO3溶液中加入足量NaHSO4溶液:2H++CO32-═CO2↑+H2O | |
| D. | 氯化亚铁溶液中加入稀硝酸 3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ |
18.反应 M+3N=2P+2Q 在四种不同条件下的反应速率为如下,则反应速率最快的是( )
| A. | v(M)=0.3mol/(L•s) | B. | v(N)=0.6mol/(L•s) | C. | v(P)=0.4mol/(L•s) | D. | v(Q)=0.45mol/(L•s) |
8.金刚石和石墨是碳元素的两种结构不同的单质.在100kPa,1mol石墨转化成金刚石需要吸热1.895kJ.据此,试判断在100kPa压强下,下列结论正确的是( )
| A. | 金刚石比石墨稳定 | B. | 1mol石墨比lmol金刚石总能量高 | ||
| C. | 石墨转化为金刚石属于化学变化 | D. | 石墨和金刚石是碳元素的同位素 |
15.下列物质的化学用语表达正确的是( )
| A. | (CH3)3COH的名称:2,2二甲基乙醇 | B. | 甲烷的球棍模型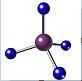 | ||
| C. | 乙醛的结构式:CH3CHO | D. | 四氯化碳分子的电子式: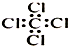 |
12.设NA表示阿伏加德罗常数.下列说法不正确的是( )
| A. | 质量均为mg的H2SO4和H3PO4中含有的电子数均为50mNA/98 | |
| B. | 标准状况下,1升辛烷完全燃烧后,所生成气态产物的分子数为8NA/22.4个 | |
| C. | 在1L0.5mol•L-1的Na2CO3溶液中,离子总数一定大于1.5NA个 | |
| D. | 1mol H2O2与MnO2充分作用下转移的电子总数为NA个 |
13.下列说法中不正确的是( )
| A. | SO2通入酸性的高锰酸钾溶液中紫红色褪去 | |
| B. | SO2通入Ba(OH)2溶液中中产生白色沉淀 | |
| C. | 久置的Na2SO3溶液中加入酸化的BaCl2溶液产生白色沉淀 | |
| D. | SO2通入氯水中无现象 |
 锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4.溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答:
锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4.溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答: