题目内容
11.下列离子方程式书写正确的是( )| A. | 硫酸亚铁溶液中加过氧化氢溶液 Fe2++2H2O2+4H+═Fe3++4H2O | |
| B. | NaHSO4溶液与Ba(OH)2溶液混合后显酸性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | NaHCO3溶液中加入足量NaHSO4溶液:2H++CO32-═CO2↑+H2O | |
| D. | 氯化亚铁溶液中加入稀硝酸 3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ |
分析 A.电子、电荷不守恒;
B.混合后显酸性,则氢氧化钡完全反应;
C.碳酸氢根离子不能拆分;
D.发生氧化还原反应,电子、电荷守恒.
解答 解:A.硫酸亚铁溶液中加过氧化氢溶液的离子反应为2Fe2++H2O2+2H+═2Fe3++2H2O,故A错误;
B.NaHSO4溶液与Ba(OH)2溶液混合后显酸性的离子反应为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故B错误;
C.NaHCO3溶液中加入足量NaHSO4溶液的离子反应为H++HCO3-═CO2↑+H2O,故C错误;
D.氯化亚铁溶液中加入稀硝酸的离子反应为3Fe2++4H++NO3-═3Fe3++2H2O+NO↑,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
1.下列有关合金的说法正确的是( )
| A. | 合金必须是由两种或两种以上的金属组成 | |
| B. | 水银是合金 | |
| C. | 形成合金后,其熔点一般会提高 | |
| D. | 形成合金后,其硬度一般会增大 |
2.下列说法正确的是( )
| A. | 不同原子构成的物质可能是单质、化合物或混合物 | |
| B. | 酸性氧化物一定是非金属氧化物 | |
| C. | 电解质溶液导电、煤的气化、石油的裂解、烧碱的潮解都是化学变化 | |
| D. | 化学变化中往往伴随着化学键的破坏与形成,而物理变化中一定没有化学键的破坏或形成 |
19.分枝酸可用于生化研究,其结构简式如图.下列关于分支酸的叙述正确的是( )
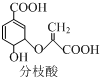

| A. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 | |
| B. | 分子中含有2种官能团 | |
| C. | 可与乙醇、乙酸反应,且反应类型相同 | |
| D. | 1mol分枝酸最多可与3molNaOH发生中和反应 |
20.如图装置能构成原电池的是( )
| A. | 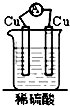 | B. |  | C. |  | D. |  |

