题目内容
2. 某实验小组对一含有Al3+的未知溶液进行分析:往该溶液逐滴滴加某浓度NaOH溶液,所加NaOH溶液体积(ml)与产生沉淀的物质的量(mol)的关系如下图所示:下列说法错误的是( )
某实验小组对一含有Al3+的未知溶液进行分析:往该溶液逐滴滴加某浓度NaOH溶液,所加NaOH溶液体积(ml)与产生沉淀的物质的量(mol)的关系如下图所示:下列说法错误的是( )| A. | 该未知溶液中至少含有3种阳离子 | |
| B. | 滴加的NaOH溶液的物质的量浓度为5mol•L-1 | |
| C. | 若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g | |
| D. | 若溶液中仅有两种金属阳离子,且另一种离子为二价阳离子,则a=10 |
分析 A、依据实验过程分析滴入氢氧化钠无沉淀,说明含有H+,继续滴入氢氧化钠溶液生成白色沉淀说明一定生成氢氧化铝沉淀,说明溶液中含有Al3+,加入过量的氢氧化钠溶液沉淀减少,但未完全消失,图象分析说明溶液中除了铝离子,应还有另一种金属阳离子;
B、依据图象分析溶解的氢氧化铝物质的量为0.20mol-0.15mol=0.05mol,消耗氢氧化钠溶液体积=110ml-100ml=10ml,氢氧化钠的浓度=$\frac{0.05mol}{0.01L}$=5mol/L;
C、最后得到的沉淀不能确定其成分,所以不能计算灼烧后得到的氧化物的质量;
D、若另一种阳离子为二价金属阳离子,依据离子反应过程金属分析判断,氢氧化铝形成最大沉淀量0.05mol,二价金属物质的量为0.15mol,消耗氢氧化钠物质的量为0.05mol×3+0.15mol×2+a×10-3L×5mol/L=0.1L×5mol/L,a=10ml.
解答 解:A、实验过程分析滴入氢氧化钠无沉淀,说明含有H+,继续滴入氢氧化钠溶液生成白色沉淀说明一定生成氢氧化铝沉淀,说明溶液中含有Al3+,加入过量的氢氧化钠溶液沉淀减少,图象分析说明溶液中除了铝离子,应还有另一种金属阳离子,该未知溶液中至少含有3种阳离子,故A正确;
B、依据图象分析溶解的氢氧化铝物质的量为0.20mol-0.15mol=0.05mol,消耗氢氧化钠溶液体积=110ml-100ml=10ml,氢氧化钠的浓度=$\frac{0.05mol}{0.01L}$=5mol/L,故B正确;
C、最后得到的沉淀不能确定其成分,所以不能计算灼烧后得到的氧化物的质量,故C错误;
D、若另一种阳离子为二价金属阳离子,生成氢氧化铝最大沉淀量0.05mol,二价金属物质的量为0.15mol,开始消耗氢氧化钠体积为aml,消耗氢氧化钠物质的量为0.05mol×3+0.15mol×2+a×10-3L×5mol/L=0.1L×5mol/L,a=10,故D正确;
故选C.
点评 本题考查了图象分析的方法掌握,物质性质的分析应用,定量计算和图象中的定量分析是解题关键,题目难度较大.

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案| A. | 与酸反应产生氢气多 | B. | 与碱反应产生氢气多 | ||
| C. | 一样多 | D. | 不知道铝粉的质量,无法比较 |
| A. | Na2O2的电子式: | B. | Cl原子的结构示意图: | ||
| C. | HClO分子的结构式:H-Cl-O | D. | 乙烯的结构简式:CH2CH2 |
(1)合成氨工业中,合成塔中每产生2mol NH3,放出92.2kJ热量.
①工业合成氨的热化学方程式是N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol.
②若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为18.44;若在同体积的容器中充人2mol N2和6molH2,达平衡后放出的热量为Q2 kJ,则Q2>(填“>”、“<”或“=”)2Q1.
③已知:

1mol N-H键断裂吸收的能量约等于391kJ.
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行合成氨反应:N2 (g)+3H2(g)?2NH3 (g),其平衡常数K与温度T的关系如表:
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②一定温度下,下列各项能作为判断该反应达到化学平衡状态的依据是bc(填字母).
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.浓度商Q=平衡常数K
c.容器内压强保持不变
d.混合气体的密度保持不变
③在400℃时,当测得N2、H2和NH3的物质的量分别为2mol、1mol、2mol时,则此时该反应处于(填“处于”或“不处于”)平衡状态.
| A. | 软水是不含Ca2+、Mg2+的水 | |
| B. | 石灰-纯碱法中石灰是指CaCO3 | |
| C. | 石灰-纯碱法软化硬水过程中,Mg2+引起的硬度转化成了Ca2+的硬度 | |
| D. | 离子交换剂不能再生 |
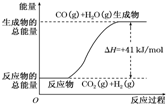 (1)已知14g N2与足量H2反应放出46kJ的热量,则该反应的热化学方程式是N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol
(1)已知14g N2与足量H2反应放出46kJ的热量,则该反应的热化学方程式是N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol →
→