题目内容
某校化学研究性学习小组在学习了金属的知识后,探究Cu的常见化合物性质.过程如下:(常见含铜元素物质及颜色:铜一红色;氧化铜-黑色;氧化亚铜一红色)
【提出问题】①在周期表中,Cu、Al位置接近.Cu不如Al活泼,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?
【实验方案】
(1)解决问题①需用到的药品有CuSO4溶液、 (填试剂),同时进行相关实验.
(2)解决问题②的实验步骤和现象如下:取98gCu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A.冷却后称量A的质量为72g,A的化学式为 .向A中加入过量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在.
【实验结论】
(1)Cu(OH)2具有两性.证明Cu(OH)2具有两性的实验现象是 .
(2)根据实验方案(2),得出的+1价Cu和+2价Cu稳定性大小的结论是:高温时 ;在酸性溶液中 .
【提出问题】①在周期表中,Cu、Al位置接近.Cu不如Al活泼,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?
【实验方案】
(1)解决问题①需用到的药品有CuSO4溶液、
(2)解决问题②的实验步骤和现象如下:取98gCu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A.冷却后称量A的质量为72g,A的化学式为
【实验结论】
(1)Cu(OH)2具有两性.证明Cu(OH)2具有两性的实验现象是
(2)根据实验方案(2),得出的+1价Cu和+2价Cu稳定性大小的结论是:高温时
考点:铜金属及其重要化合物的主要性质,性质实验方案的设计
专题:几种重要的金属及其化合物
分析:【实验方案】
(1)要证明Cu(OH)2具有两性,应先加入碱生成Cu(OH)2,根据提供的药品可确定还需要的药品;
(2)根据质量守恒计算中含有1molCu,质量为64g,剩余为O元素;
【实验结论】
(1)根据两性氢氧化物的性质来分析,如具有两性,Cu(OH)2既能溶解于强酸,又能溶解于强碱;
(2)根据在不同温度下反应物的组成可确定物质的稳定性.
(1)要证明Cu(OH)2具有两性,应先加入碱生成Cu(OH)2,根据提供的药品可确定还需要的药品;
(2)根据质量守恒计算中含有1molCu,质量为64g,剩余为O元素;
【实验结论】
(1)根据两性氢氧化物的性质来分析,如具有两性,Cu(OH)2既能溶解于强酸,又能溶解于强碱;
(2)根据在不同温度下反应物的组成可确定物质的稳定性.
解答:
解:【实验方案】(1)Cu不如Al活泼,可以用硫酸溶液进行验证,要证明Cu(OH)2具有两性,应先加入碱生成Cu(OH)2,药品中缺少氢氧化钠溶液,故答案为:稀硫酸、氢氧化钠溶液;
(2)98g Cu(OH)2固体的物质的量为1mol,解热分解生成的72g固体中含有Cu的质量为1mol,即64g,则氧原子的质量为72g-64g8g,n(O)=
=0.5mol,
则A中n(Cu):n(O)=2:1,故答案为:Cu2O;
【实验结论】
(1)如具有两性,Cu(OH)2既能溶解于强酸,又能溶解于强碱,分别生成盐和水,故答案为:Cu(OH)2既能溶解于强酸,又能溶解于强碱;
(2)80℃~100℃时,得到黑色固体粉末,为CuO,继续加热到1000℃以上,黑色粉末全部变成红色粉末,说明在较高温度时Cu2O稳定,与酸反应生成硫酸铜和铜,说明在酸性条件下+2价的铜稳定,故答案为:Cu+稳定性大于Cu2+;Cu2+稳定性大于Cu+.
(2)98g Cu(OH)2固体的物质的量为1mol,解热分解生成的72g固体中含有Cu的质量为1mol,即64g,则氧原子的质量为72g-64g8g,n(O)=
| 8g |
| 16g/mol |
则A中n(Cu):n(O)=2:1,故答案为:Cu2O;
【实验结论】
(1)如具有两性,Cu(OH)2既能溶解于强酸,又能溶解于强碱,分别生成盐和水,故答案为:Cu(OH)2既能溶解于强酸,又能溶解于强碱;
(2)80℃~100℃时,得到黑色固体粉末,为CuO,继续加热到1000℃以上,黑色粉末全部变成红色粉末,说明在较高温度时Cu2O稳定,与酸反应生成硫酸铜和铜,说明在酸性条件下+2价的铜稳定,故答案为:Cu+稳定性大于Cu2+;Cu2+稳定性大于Cu+.
点评:本题考查实验探究和数据处理,做题时注意两性氢氧化物的性质以及质量守恒定律计算物质的化学式.本题有一定难度.

练习册系列答案
相关题目
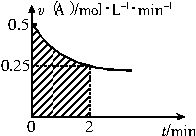 某溶液中发生反应A
某溶液中发生反应A| 无 |
| 无 |
| A、反应开始的前2min,A的平均反应速率小于0.375mol?L-1?min-1 |
| B、图中阴影部分的面积表示0~2min内A的物质的量浓度的减小值 |
| C、图中阴影部分的面积表示0~2min内A的物质的量的减小值 |
| D、至2min时,B的物质的量浓度c(B)介于1~1.5mol?L-1之间 |
在某100mL混合酸中,硝酸物质的量浓度为0.4mol/L,硫酸物质的量浓度为0.2mol/L,向其中加入3.2g铜粉,微热,待其充分反应后,溶液中铜离子的物质的量浓度约为( )
| A、0.15mol/L |
| B、0.3mol/L |
| C、0.5mol/L |
| D、无法计算 |

 乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某校化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.
乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某校化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答. A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.它们之间的关系如下:
A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.它们之间的关系如下: