题目内容
9.下列实验操作能达到实验目的是( )| 实验目的 | 实验操作 | |
| A | 实验室制大量CO2 | 向石灰石中加入稀硫酸 |
| B | 证明某溶液中含有SO42- | 向该溶液中滴入BaCl2溶液 |
| C | 配制0.1mol/L CuSO4溶液 | 把2.5g胆矾晶体溶于水配成100mL溶液 |
| D | 制备Fe(OH)3胶体 | 将饱和的FeCl3溶液滴加到热NaOH溶液中 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.碳酸钙和稀硫酸反应生成微溶性的硫酸钙;
B.硫酸根离子用盐酸酸化的氯化钡溶液检验;
C.配制0.1mol/L CuSO4溶液,如果配制100mL溶液,则需要称量胆矾的质量=0.1mol/L×0.1L×250g/mol;
D.氯化铁和氢氧化钠反应生成氢氧化铁沉淀.
解答 解:A.碳酸钙和稀硫酸反应生成微溶性的硫酸钙附着在碳酸钙表面而阻止进一步反应,应该用稀盐酸和石灰石制取二氧化碳,故A错误;
B.硫酸根离子用盐酸酸化的氯化钡溶液检验,防止碳酸根离子、亚硫酸根离子等离子的干扰,故B错误;
C.配制0.1mol/L CuSO4溶液,如果配制100mL溶液,则需要称量胆矾的质量=0.1mol/L×0.1L×250g/mol=2.5g,故C正确;
D.氯化铁和氢氧化钠反应生成氢氧化铁沉淀,氢氧化铁胶体的制备:向沸水中加入几滴饱和氯化铁溶液,加热至溶液呈红褐色为止,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及离子检验、气体制取、溶液配制、物质制备等知识点,明确实验原理及元素化合物性质是解本题关键,侧重考查学生分析及实验评价能力,注意硫酸铜和胆矾成分不同,知道氢氧化铁胶体的制备方法,题目难度不大.

练习册系列答案
相关题目
19.从物质分类的角度进行下列判断,正确的是( )
| A. | 根据是否具有丁达尔效应,可将分散系分为溶液、浊液和胶体 | |
| B. | SiO2既能与NaOH溶液反应,又能与氢氟酸反应,但SiO2不属于两性氧化物 | |
| C. | AgCl的水溶液不易导电,故AgCl是弱电解质 | |
| D. | 烧碱、纯碱、熟石灰均属于碱 |
20.甲醇是重要的工业原料.煤化工可以利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g)?CH3OH(g).已知常温常压下反应的能量变化如图1所示: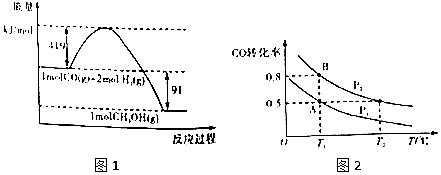
②
(3)CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-280kJ/mol
H2(g)+$\frac{1}{2}$O2(g)=H2O(I)△H=-284kJ/mol
H2O(I)=H2O(g)△H=+44kJ/mol
请回答下列问题:
(1)甲醇气体分解为CO和H2两种气体这一反应的活化能为510kj/mol;
(2)请写出表示气态甲醇燃烧热的热化学方程式CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-757kJ•mol-1;
(3)H-O的键能x值为462;
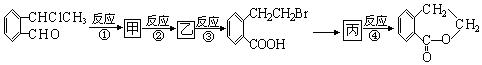
(4)如图2:在一容积可变的密闭容器中充入10molCO气体和30molH2气体,当达到平衡状态A时,容器的体积为20L.如反应开始时仍充入10molCO和30molH2,则在平衡状态B时容器的体积V(B)=7L;
(5)在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生该反应(起始温度和起始体积相同,反应物和生成物反应前后均为气态).相关数据如表所示:
则下列说法正确的是BC.
A.V(甲)>V(丙)B.K(乙)>K(丙)
C.c(乙)>c(甲) D.v(甲)=v(丙)

②
| 化学键 | H-H | H-O | O=O |
| 键能kj/mol | 436 | x | 496 |
H2(g)+$\frac{1}{2}$O2(g)=H2O(I)△H=-284kJ/mol
H2O(I)=H2O(g)△H=+44kJ/mol
请回答下列问题:
(1)甲醇气体分解为CO和H2两种气体这一反应的活化能为510kj/mol;
(2)请写出表示气态甲醇燃烧热的热化学方程式CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-757kJ•mol-1;
(3)H-O的键能x值为462;
(4)如图2:在一容积可变的密闭容器中充入10molCO气体和30molH2气体,当达到平衡状态A时,容器的体积为20L.如反应开始时仍充入10molCO和30molH2,则在平衡状态B时容器的体积V(B)=7L;
(5)在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生该反应(起始温度和起始体积相同,反应物和生成物反应前后均为气态).相关数据如表所示:
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | 1molCO、2molH2 | 1molCH3OH | 1molCH3OH |
| 平衡时容器体积 | V(甲) | V(乙) | V(丙) |
| 反应的平衡常数K | K(甲) | K(乙) | K(丙) |
| 平衡时CH3OH的浓度/mol•L-1 | C(甲) | C(乙) | C(丙) |
| 平衡时CH3OH的反应速率/mol•L-1•min-1 | v(甲) | v(乙) | v(丙) |
A.V(甲)>V(丙)B.K(乙)>K(丙)
C.c(乙)>c(甲) D.v(甲)=v(丙)
17.下列实验能达到测量要求的是( )
| A. | 用托盘天平称取35.20g NaOH | |
| B. | 用10mL量筒量取8.50mL浓盐酸配一定物质的量浓度溶液 | |
| C. | 用25ml滴定管量取15.80ml浓溶液配一定物质的量浓度溶液 | |
| D. | 用pH试纸测得溶液pH为4.2 |
4.用容量瓶准确配制一定浓度的NaCl溶液时,下列操作会使溶液浓度偏低的是( )
| A. | 用粗盐代替NaCl固体 | |
| B. | 定容时,溶液液面低于容量瓶刻度线 | |
| C. | 从烧杯向容量瓶转移溶液时,有少量溶液溅出 | |
| D. | 向容量瓶转移溶液时,容量瓶中有少量蒸馏水 |
1.与离子方程式H++OH-=H2O相对应的化学方程式是( )
| A. | Mg(OH)2+2HCl═MgCl2+2H2O | B. | 2NaOH+H2SO4═Na2SO4+2H2O | ||
| C. | Ba(OH)2+H2SO4═BaSO4↓+2H2O | D. | CH3COOH+NaOH═CH3COONa+H2O |
19.NA为阿伏加徳罗常数的值,下列叙述正确的是( )
| A. | lmol Cl2与足量的铁充分反应,.转移的电子数为2NA | |
| B. | 标准状况下,11.2L水所含分子数为0.5NA | |
| C. | 常温常压下,22.4L氖气含有NA个氖原子 | |
| D. | 124g Na2O溶于水后所得溶液中含有O2-离子数为2NA |
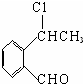 +O2$\stackrel{催化剂}{→}$2
+O2$\stackrel{催化剂}{→}$2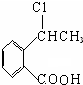 ,氧化反应.
,氧化反应.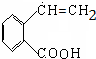 +NaCl+H2O,消去反应.
+NaCl+H2O,消去反应. →丙实际需要两步才能完成,写出第一步反应的化学方程式
→丙实际需要两步才能完成,写出第一步反应的化学方程式 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +NaBr+H2O,第二步所用试剂及目的是试剂是盐酸,目的是将钠盐酸化生成对应的酸.
+NaBr+H2O,第二步所用试剂及目的是试剂是盐酸,目的是将钠盐酸化生成对应的酸.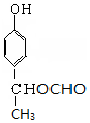 和
和 .
.