题目内容
13.用NA表示阿伏德罗常数,下列叙述正确的是( )| A. | 标准状况下,22.4LCCl4含有的分子数为1 NA | |
| B. | 常温常压下,16g O2含有的原子数为1 NA | |
| C. | 通常状况下,1 NA 个CO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol/L的BaCl2溶液中,含有Cl- 个数为1 NA |
分析 A.标况下,四氯化碳为液体;
B.依据n=$\frac{m}{M}$计算;
C.通常状况下,Vm>22.4L/mol;
D.溶液体积未知.
解答 解:A.标况下,四氯化碳为液体,不能使用气体摩尔体积,故A错误;
B.氧气有氧原子构成,常温常压下,16g O2含有的原子数为$\frac{16g}{16g/mol}$×NA=1 NA,故B正确;
C.通常状况下,Vm>22.4L/mol,所以1 NA 个CO2分子占有的体积大于22.4L,故C错误;
D.溶液体积未知,无法计算溶液中氯离子个数,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意气体摩尔体积使用条件和对象,题目难度不大.

练习册系列答案
相关题目
1.工业上曾经通过反应“3Fe+4NaOH$\stackrel{1100℃}{?}$Fe3O4+2H2↑4Na↑”生产金属钠,己知铁的熔点1535℃、沸点3000℃.下列有关说法正确的是( )
| A. | 增大铁的量可以使反应速率加快 | |
| B. | 将生成的气体在空气中冷却可获得钠 | |
| C. | 每生成1molH2,转移的电子数约为4×6.02×1023 | |
| D. | 该反应条件下铁的金属性比钠强 |
5.下列有关过滤和蒸发的操作中,正确的是( )
| A. | 过滤时,漏斗的下端管口紧靠烧杯内壁 | |
| B. | 为了加快过滤速度,可用玻璃棒搅动过滤器中的液体 | |
| C. | 实验完毕后,用手直接取走蒸发皿 | |
| D. | 当蒸发皿中的固体完全蒸干后,再停止加热 |
1.下列化合物属于混合物的是( )
| A. | 纤维素 | B. | 氯乙烯 | C. | 冰醋酸 | D. | 乙酸乙酯 |
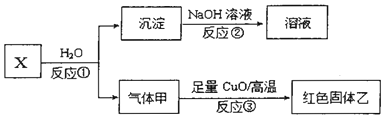
 写出反应①的化学方程式Al4C3+12H2O=4Al(OH)3+3CH4.
写出反应①的化学方程式Al4C3+12H2O=4Al(OH)3+3CH4.
 2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是( )
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是( )