题目内容
8.短周期元素形成的纯净物A、B、C、D、E之间的转化关系如图1所示,A与B之间的反应不在溶液中进行(E可能与A、B两种物质中的一种相同).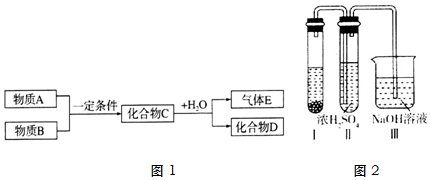
请回答下列问题:
(1)若A是气态单质,D是一种强碱.
①物质B为Na或Na2O(填化学式)
②将化合物C加入石蕊试液中的现象固体溶解,溶液的颜色先变蓝后褪色,同时有气泡产生
(2)若C是一种气体,D是一种强酸.
①写出C与水反应的化学方程式为3NO2+H2O=2HNO3+NO.
②有人认为“浓H2SO4可以干燥气体C”.某同学为了验证该观点是否正确,用如图2所示装置进行实验.
装置I中的试剂为浓硝酸、铜;实验过程中,在浓H2SO4中未发现有气体逸出,则得出的结论是NO2能溶于浓硫酸中,浓硫酸不能干燥NO2.
分析 (1)若A是气态单质,D是一种强碱,可能为NaOH,则C可为Na2O2,生成气体E可能为O2或H2;
(2)C是有色气体,应为NO2,则D为HNO3,E为NO,结合物质的性质解答该题.
解答 解:(1)若A是气态单质,D是一种强碱,可能为NaOH,则C可为Na2O2,生成气体E可能为O2或H2,
①A为氧气,C为过氧化钠,则B可能为Na或Na2O,故答案为:Na或Na2O;
②过氧化钠可与水反应生成氢氧化钠和氧气,溶液呈碱性,加入酚酞变红色,因过氧化钠具有强氧化性,可具有漂白作用,最终溶液褪色,
故答案为:固体溶解,溶液的颜色先变蓝后褪色,同时有气泡产生;
(2)C是有色气体,应为NO2,则D为HNO3,E为NO,
①二氧化氮和水反应生成一氧化氮和硝酸,方程式为3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
②装置I用于制备二氧化氮,可用浓硝酸与铜反应制得,由现象实验过程中,浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,可以得出NO2能溶于浓硫酸中,
故答案为:浓硝酸、铜;NO2能溶于浓硫酸中,浓硫酸不能干燥NO2.
点评 本题考查无机物的推断,为高考常见题型,侧重考查学生的分析能力,题目以物质的性质为载体综合考查物质的性质探究,题目难度中等,明确物质的种类为解答该题的关键.

练习册系列答案
相关题目
19.下列有关化学与生活、工业的叙述中,不正确的是( )
| A. | 工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料 | |
| B. | 高空中臭氧层能够吸收太阳紫外线,为地球上的生物提供了天然的保护屏障,但低空的臭氧浓度过大,会给生物造成伤害 | |
| C. | 2011年5月份起,面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,过氧化苯甲酰属于有机物 | |
| D. | 用K2FeO4代替Cl2处理饮用水,有杀菌消毒作用,且不会形成致癌物,还有净水作用 |
3.下列有关乙醇性质的化学方程式正确的是( )
| A. | 与金属钠反应:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ | |
| B. | 与氧气的燃烧反应:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | |
| C. | 与氧气的催化氧化:CH3CH2OH+3O2$\stackrel{点燃}{→}$2CO2+3H2O | |
| D. | 与乙酸的酯化反应:CH3COOH+CH3CH2OH$\frac{\underline{\;浓硫酸\;}}{△}$CH3COOCH2CH3 |
13.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LCCl4含有的分子数为1 NA | |
| B. | 常温常压下,16g O2含有的原子数为1 NA | |
| C. | 通常状况下,1 NA 个CO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol/L的BaCl2溶液中,含有Cl- 个数为1 NA |
20.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标况下,22.4LSO3含氧原子数为3NA | |
| B. | 将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA | |
| C. | 2 molSO2和1 molO2在密闭容器中加热(V2O5催化)充分反应后,容器内分子总数大于2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
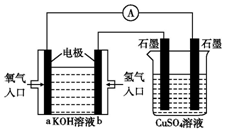 可用碱性氢氧燃料电池组装如图所示的装置:
可用碱性氢氧燃料电池组装如图所示的装置: 2Z(g),增大容积,减小压强时,对反应产生的影响是( )
2Z(g),增大容积,减小压强时,对反应产生的影响是( )