题目内容
8.下列物质转化在给定条件下能实现的是( )①Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3
②S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4
③Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3
④饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3
⑤MgCl2(aq)$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{煅烧}{→}$MgO.
| A. | ②④⑤ | B. | ②③④ | C. | ①③⑤ | D. | ①④⑤ |
分析 ①氧化铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠溶液通入二氧化碳,生成氢氧化铝;
②硫燃烧生成二氧化硫;
③氧化铁与盐酸反应生成氯化铁,Fe3+水解,加热蒸发得不到无水FeCl3;
④饱和的氯化钠溶液中先通入氨气,再通入二氧化碳,溶液中碳酸氢根离子浓度增大,由于碳酸氢钠的溶解度相对较小,析出碳酸氢钠,碳酸氢钠加热分解生成碳酸钠;
⑤氯化镁与石灰乳转化为更难溶的氢氧化镁,氢氧化镁不稳定,加热分解生成氧化镁.
解答 解:①氧化铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠溶液通入二氧化碳,生成氢氧化铝,所以Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3,可以实现,故正确;
②硫燃烧生成二氧化硫,得不到三氧化硫,所以S$\stackrel{O_{2}/点燃}{→}$SO3不能实现,故错误;
③氧化铁与盐酸反应生成氯化铁,Fe3+水解,加热蒸发得到的是氢氧化铁,得不到无水FeCl3,所以FeCl3(aq)$\stackrel{△}{→}$无水FeCl3不能实现,故错误;
④饱和的氯化钠溶液中先通入氨气,再通入二氧化碳,溶液中碳酸氢根离子浓度增大,由于碳酸氢钠的溶解度相对较小,析出碳酸氢钠,碳酸氢钠加热分解生成碳酸钠,所以饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 可以实现,故正确;
⑤氯化镁与石灰乳转化为更难溶的氢氧化镁,氢氧化镁不稳定,加热分解生成氧化镁,所以MgCl2(aq)$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{煅烧}{→}$MgO可以实现,故正确;
故选:D.
点评 本题考查较为综合,侧重于元素化合物知识的综合考查与应用,明确物质的性质是解题关键,题目难度不大.

| A. | C2H5OH | B. | CH3COOH | C. | CH3CHO | D. | HCOOCH3 |
实验一:配制并标定醋酸溶液的浓度
取冰醋酸配制250mL 0.2mol/L的醋酸溶液,用0.2mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对稀释后醋酸溶液的浓度进行标定.回答下列问题:
(1)配制250mL 0.2mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为标定某醋酸溶液的准确浓度,用0.2000mol/L的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶 液的体积(mL) | 20.05 | 20.00 | 18.50 | 19.95 |
实验二:探究浓度对醋酸电离程度的影响
用pH计测定25°C时不同浓度的醋酸的pH,结果如下:
| 醋酸浓度 (mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是0.010 0 mol/L 醋酸的pH大于2
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度增大(填“增大”、“减小”或“不变”).
(5)实验三:该同学用pH计测定相同浓度的醋酸在几种不同温度时的pH,该同学的实验目的是:用pH计测定相同浓度的醋酸在几种不同温度时的pH.
| A. | 熔点:金刚石>食盐>干冰 | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 沸点:HF>HBr>HCl | D. | 离子半径:Na+<Mg2+<Al3+ |
| A. | X、Y、Z的物质的量之比为1:3:2 | |
| B. | X、Y、Z的浓度不再发生变化 | |
| C. | 单位时间内生成2n mol Z,同时消耗3n mol Y | |
| D. | 单位时间内消耗n mol X,同时消耗3n mol Y |
| A. | ${\;}_{1}^{2}$H原子的中子数和质子数 | |
| B. | ${\;}_{18}^{36}$Ar原子中的质量数和中子数 | |
| C. | ${\;}_{4}^{8}$Be2+离子中的电子数和质子数 | |
| D. | ${\;}_{12}^{26}$Mg2+离子中的中子数和电子数 |
2CrO${\;}_{4}^{2-}$$\underset{\stackrel{{H}^{+}}{→}}{转换}$Cr2O${\;}_{7}^{2-}$$\underset{\stackrel{F{e}^{2+}}{→}}{还原}$Cr3+$\underset{\stackrel{O{H}^{-}}{→}}{沉淀}$Cr(OH)3↓
已知转化过程中的反应为2CrO${\;}_{4}^{2-}$(aq)+2H+(aq)?Cr2O${\;}_{7}^{2-}$(aq)+H2O(l)
,转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有$\frac{10}{11}$转化为Cr2072-,下列说法不正确的是( )
| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeS04•7H2O)作还原剂,处理1 L废水,至少需要458.7g | |
| C. | 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5 | |
| D. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 |
 .
. )广泛用于集成电路的制备和微细图形的加工.下面是有机物X的一种合成路线:
)广泛用于集成电路的制备和微细图形的加工.下面是有机物X的一种合成路线: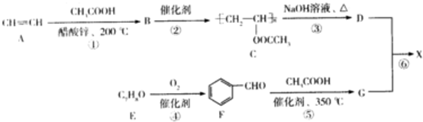

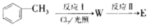
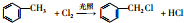 ,反应Ⅱ的试剂为氢氧化钠水溶液、加热.
,反应Ⅱ的试剂为氢氧化钠水溶液、加热.