题目内容
16.下列各组顺序的排列不正确的是( )| A. | 熔点:金刚石>食盐>干冰 | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 沸点:HF>HBr>HCl | D. | 离子半径:Na+<Mg2+<Al3+ |
分析 A.熔点:原子晶体>离子晶体>分子晶体;
B.元素的非金属性越强,其氢化物的稳定性越强;
C.结构相似的分子晶体,分子晶体的熔沸点与其相对分子质量成正比,但含有氢键的熔沸点较高;
D.电子层结构相同的离子,离子半径随着原子序数增大而减小.
解答 解:A.熔点:原子晶体>离子晶体>分子晶体,金刚石是原子晶体、食盐是离子晶体、干冰是分子晶体,所以熔点:金刚石>食盐>干冰,故A正确;
B.元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>S>P,所以氢化物的稳定性:HCl>H2S>PH3,故B正确;
C.结构相似的分子晶体,分子晶体的熔沸点与其相对分子质量成正比,但含有氢键的熔沸点较高,这几种氢化物都是分子晶体,但HF中含有氢键,所以沸点:HF>HBr>HCl,故C正确;
D.电子层结构相同的离子,离子半径随着原子序数增大而减小,这几种离子电子层结构相同,原子序数Na<Mg<Al,所以离子半径Na+>Mg2+>Al3+,故D错误;
故选D.
点评 本题考查晶体熔沸点高低判断、离子半径大小比较、氢化物的稳定性等,明确晶体类型及晶体熔沸点高低影响因素是解本题关键,分子晶体与分子间作用力有关、原子晶体与共价键强弱有关、金属晶体与金属键强弱有关、离子晶体与晶格能大小有关,知道非金属性强弱判断方法,题目难度不大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
6.工业上由焦炭或天然气制氢气的过程中会产生一氧化碳.为了除去氢气中混有的一氧化碳,可在催化剂存在的条件下发生反应:
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.0kJ/mol
该反应在工业上被称为“一氧化碳变换”反应.
(1)在一个容积为1L的密闭容器中加入1molCO和3molH2O(g),发生上述反应,5min后达到平衡,测得该反应实际放出的热量为20.5kJ,迅速导出热量,保持容器中温度不变.则该时间范围内反应的平均速率ν(CO)=0.1mol/(L•min);平衡常数K的数值为0.2.
(2)某工业合成氨的原料气组成为:H2 40%、N2 20%、CO 30%、CO210%(均为体积分数).
现采用“一氧化碳变换”法,向上述原料气中加入水蒸气,将其中的CO除去.已知不同温度
及反应物投料比($\frac{n({H}_{2}O)}{n(CO)}$)下,变换反应后平衡混合气体中CO的体积分数如下表所示:
①平衡混合气体中CO的体积分数越大,则CO的平衡转化率越小(填“大”或“小”).
②从该反应的化学方程式分析,反应物投料比($\frac{n({H}_{2}O)}{n(CO)}$)越大,CO的平衡转化率越大(填
“大”或“小”),与上表中的数据分析结果相符(填“相符”或“不符”).根据对上表的分析,为提高CO平衡转化率,还可以采取的措施是降低温度.
③不同温度下该反应K值:K(300℃)<K(200℃)(填“>”、“=”或“<”).
④温度是一氧化碳变换工艺中最重要的条件,实际生产过程中将温度控制在300℃左右,其原因是升高温度,会提高反应速率,但平衡逆向移动,CO的平衡转化率下降,实际生产中应综合考虑速率和平衡两个方面.
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.0kJ/mol
该反应在工业上被称为“一氧化碳变换”反应.
(1)在一个容积为1L的密闭容器中加入1molCO和3molH2O(g),发生上述反应,5min后达到平衡,测得该反应实际放出的热量为20.5kJ,迅速导出热量,保持容器中温度不变.则该时间范围内反应的平均速率ν(CO)=0.1mol/(L•min);平衡常数K的数值为0.2.
(2)某工业合成氨的原料气组成为:H2 40%、N2 20%、CO 30%、CO210%(均为体积分数).
现采用“一氧化碳变换”法,向上述原料气中加入水蒸气,将其中的CO除去.已知不同温度
及反应物投料比($\frac{n({H}_{2}O)}{n(CO)}$)下,变换反应后平衡混合气体中CO的体积分数如下表所示:
| 温度/℃\CO的体积分数%\投料比 | $\frac{n({H}_{2}O)}{n(CO)}$=1 | $\frac{n({H}_{2}O)}{n(CO)}$=3 | $\frac{n({H}_{2}O)}{n(CO)}$=5 |
| 200 250 300 350 | 1.70 2.73 6.00 7.85 | 0.21 0.30 0.84 1.52 | 0.02 0.06 0.43 0.80 |
②从该反应的化学方程式分析,反应物投料比($\frac{n({H}_{2}O)}{n(CO)}$)越大,CO的平衡转化率越大(填
“大”或“小”),与上表中的数据分析结果相符(填“相符”或“不符”).根据对上表的分析,为提高CO平衡转化率,还可以采取的措施是降低温度.
③不同温度下该反应K值:K(300℃)<K(200℃)(填“>”、“=”或“<”).
④温度是一氧化碳变换工艺中最重要的条件,实际生产过程中将温度控制在300℃左右,其原因是升高温度,会提高反应速率,但平衡逆向移动,CO的平衡转化率下降,实际生产中应综合考虑速率和平衡两个方面.
7.下列离子方程式书写正确的是( )
| A. | 石炭酸与NaOH溶液混合:H++OH-→H2O | |
| B. | 稀HNO3洗涤试管中的银镜:Ag+NO3-+2H+═Ag++NO↑+H2O | |
| C. | 乙烯使酸性KMnO4褪色:5C2H4+12MnO4-+36H+→12Mn2++10CO2↑+28H2O | |
| D. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热: |
4.X、Y、Z是短周期的三种相邻元素,X和Y在同一周期,Y和Z在同一主族,这三种元素原子的最外层电子数之和为19,且原子序数之和为41,则X、Y、Z的元素符号分别为( )
| A. | N、O、S | B. | Cl、S、O | C. | Si、P、N | D. | S、Cl、F |
5.下列变化过程中肯定要放出热量的是( )
| A. | H2→H+H | B. | H+Cl→HCl | ||
| C. | H2O(l)→H2O(g) | D. | CaCO3$\stackrel{高温}{→}$CaO+CO2 |
6.某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl.下列说法正确的是( )

| A. | 正极反应为Ag-e-=Ag+ | |
| B. | 放电时,交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 当电路中转移0.1mol e-,通过交换膜的阳离子为0.2mol | |
| D. | 用KCl溶液代替盐酸,则电池总反应不改变 |
 +2HNO3$→_{100-110℃}^{浓硫酸}$
+2HNO3$→_{100-110℃}^{浓硫酸}$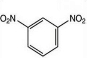 +2H2O.
+2H2O.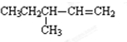
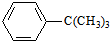 .
.