题目内容
18.还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:2CrO${\;}_{4}^{2-}$$\underset{\stackrel{{H}^{+}}{→}}{转换}$Cr2O${\;}_{7}^{2-}$$\underset{\stackrel{F{e}^{2+}}{→}}{还原}$Cr3+$\underset{\stackrel{O{H}^{-}}{→}}{沉淀}$Cr(OH)3↓
已知转化过程中的反应为2CrO${\;}_{4}^{2-}$(aq)+2H+(aq)?Cr2O${\;}_{7}^{2-}$(aq)+H2O(l)
,转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有$\frac{10}{11}$转化为Cr2072-,下列说法不正确的是( )
| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeS04•7H2O)作还原剂,处理1 L废水,至少需要458.7g | |
| C. | 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5 | |
| D. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol/L,应调溶液的pH=5 |
分析 A.存在平衡:2Cr O42-(黄色)+2H+?Cr2O72-(橙色)+H2O,如颜色不变,则达到平衡状态;
B.若1L酸化后所得溶液中含铬元素的质量为28.6g,根据守恒列关系式:2Cr~2CrO42-~Cr2O72-~2Cr3+~6e-~6FeSO4•7H2O计算;
C.酸化时发生的反应为:2CrO42-+2H+?Cr2O72-+H2O,若1L酸化后所得溶液中含铬元素的质量为28.6g,CrO42-有$\frac{10}{11}$转化为Cr2O72-,说明铬元素有$\frac{10}{11}$转化为Cr2O72-,计算平衡浓度,结合平衡常数计算;
D.根据溶度积常数列式计算.
解答 解:转化后所得溶液中铬元素含量为28.6g/L,则1L废水中n(Cr)=$\frac{28.6g}{52g/mol}$=0.55mol,
A.存在平衡:2Cr O42-(黄色)+2H+?Cr2O72-(橙色)+H2O,如颜色不变,说明浓度不变,则达到平衡状态,故A正确;
B.若用绿矾(FeSO4•7H2O)(M=278)作还原剂,处理1L废水,设需要xmolFeSO4•7H2O,由氧化还原反应中氧化剂和还原剂得失电子数目相等可知0.55×(6-3)=x×(3-2),x=1.65,m(FeSO4•7H2O)=1.65mol×278g/mol=458.7g,故B正确;
C.1L废水中n(Cr)=$\frac{28.6g}{52g/mol}$=0.55mol,CrO42-有$\frac{10}{11}$转化为Cr2O72-,则酸化后c(CrO42-)=0.55mol/L×(1-$\frac{10}{11}$)=0.05mol/L,c(Cr2O72-)=0.55mol/L×$\frac{10}{11}$×$\frac{1}{2}$=0.25mol/L,常温下转换反应的平衡常数K=1×1014,则$\frac{c(C{r}_{2}{{O}_{7}}^{2-})}{{c}^{2}(Cr{{O}_{4}}^{2-})•{c}^{2}({H}^{+})}$=1×1014,c(H+)=1×10-6mol/L,所以pH=6,故C错误;
D.常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中c(Cr3+)降至1×10-5mol/L,则c(Cr3+)×c3(OH-)=1×10-32,c(OH-)=1×10-9mol/L,pH=5,故D正确.
故选C.
点评 本题考查难溶电解质的溶解平衡,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用,难度中等.

| A. | 氢是原子半径最小的元素 | |
| B. | 稀有气体元素原子的最外层电子数均为8 | |
| C. | 周期表中有7个主族、7个副族 | |
| D. | 硫元素位于第三周期VIA族 |

| A. | 正极反应为Ag-e-=Ag+ | |
| B. | 放电时,交换膜右侧溶液中有大量白色沉淀生成 | |
| C. | 当电路中转移0.1mol e-,通过交换膜的阳离子为0.2mol | |
| D. | 用KCl溶液代替盐酸,则电池总反应不改变 |
| 序号 | ① | ② | ③ | ④ |
| 溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
| pH | 7.0 | 7.0 | 8.1 | 8.4 |
| A. | 酸性强弱:H2CO3>HF | |
| B. | ①和②中溶质均未水解 | |
| C. | 离子的总浓度:①>③ | |
| D. | ④中:c(HCO3-)+2c(CO32-)+c(H2CO3)═0.1 mol/L |
①二氧化碳与赤热的炭反应生成一氧化碳 ②葡萄糖在人体内氧化分解
③锌粒与稀H2SO4反应制取H2④Ba(OH)2•8H2O固体与NH4Cl固体反应
⑤植物通过光合作用将CO2转化为葡萄糖.
| A. | ②④ | B. | ①⑤ | C. | ①③④⑤ | D. | ①④⑤ |
| A. | IA族元素的金属性比IIA族元素的金属性强 | |
| B. | 第三周期元素的离子半径从左到右逐渐减小 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增加 | |
| D. | VIA族元素的氢化物中,稳定性最好的其沸点也最高 |
| 主 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
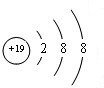
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是NaOH,呈两性的氢氧化物是Al(OH)3;
(3)按要求写出下列两种物质的电子式:①的氢化物的结构式为
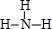 ; ②、⑦的氢化物的沸点更高的是HF;原因是HF分子之间存在氢键.
; ②、⑦的氢化物的沸点更高的是HF;原因是HF分子之间存在氢键.(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
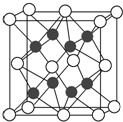 化合物Na2O的晶胞如图.
化合物Na2O的晶胞如图.