题目内容
3.某金属重2.4g,其原子核外有1.2mol 电子,核内共有7.224×1023个中子,该金属与足量盐酸反应,有0.2mol电子发生转移,生成了6.02×1022个阳离子.(1)该金属元素符号是Mg,摩尔质量是24g/mol.
(2)原子核内有12个质子,12个中子.
(3)写出该金属与盐酸反应生成的氯化物的电子式
 .
.
分析 6.02×1022个阳离子说明金属的物质的量为0.1mol,则原子中电子数为$\frac{1.2mol}{0.1mol}$=12,中子数为$\frac{7.224×1{0}^{23}}{6.02×1{0}^{22}}$=12,再根据M=$\frac{m}{n}$求出摩尔质量,摩尔质量在数值上近似等于质量数,利用质子数+中子数=质量数求出质子数,从而确定原子序数和元素符号.
解答 解:6.02×1022个阳离子说明金属的物质的量为0.1mol,则原子中电子数为$\frac{1.2mol}{0.1mol}$=12,中子数为$\frac{7.224×1{0}^{23}}{6.02×1{0}^{22}}$=12,M=$\frac{m}{n}$=$\frac{2.4g}{0.1mol}$=24g/mol,摩尔质量在数值上近似等于质量数,质子数=质量数-中子数=24-12=12,该金属元素符号为Mg.
(1)该元素的质子数为12,即是镁元素,符号为Mg;其摩尔质量为 24g/mol;
故答案为:Mg;24g/mol;
(2)Mg原子内含有12个质子,12个中子;
故答案为:12;12;
(3)氯化镁为离子化合物,化学式中存在阴阳离子,其电子式中需要标出阴阳离子所带电荷,氯化镁的电子式为: ,
,
故答案为: .
.
点评 本题考查了原子中的质子数、中子数以及电子数之间的关系、电子式的书写,题目难度不大,根据各微粒数之间的关系求出质子数确定元素是解题的关键.

练习册系列答案
相关题目
13.温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g)?PCl3(g)+Cl2(g)通过一段时间后达到平衡.反应过程中测定的部分数据见下表.下列说法正确的是( )
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在 前50s的平均速率v(PCl5)=0.0032mol.L-1.s-1 | |
| B. | 保持其它条件不变,升高温度,平衡时c(PCl5)=0.11mol.L-1,则该反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2反应达到平衡前v正>v逆 | |
| D. | 相同温度下,起始时向容器中充入2.0molPCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80% |
14.下列装置应用于实验室制取氯气并回收氯化锰溶液,不能达到实验目的是( )
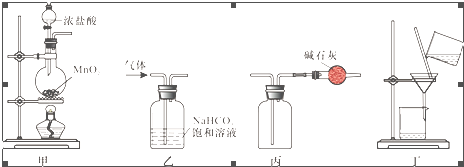

| A. | 用装置甲制取氯气 | |
| B. | 用装置乙除去氯气中的少量氯化氢 | |
| C. | 用装置丙收集氯气并防止污染空气 | |
| D. | 用装置丁分离二氧化锰和氯化锰溶液 |
18. 转变为
转变为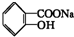 的方法是( )
的方法是( )
 转变为
转变为 的方法是( )
的方法是( )| A. | 与足量NaOH溶液共热后,再加盐酸 | |
| B. | 溶液加热,通入足量的SO2 | |
| C. | 与稀硫酸共热后,加入足量NaOH溶液 | |
| D. | 与足量稀硫酸共热后,加入足量NaHCO3溶液 |
15.关于元素周期表中元素分布的描述,正确的是( )
| A. | 周期表中的主族都有非金属元素 | |
| B. | 周期表中的主族都有金属元素 | |
| C. | 周期表中的金属元素都位于长周期 | |
| D. | 周期表中的非金属元素都位于主族和0族 |
13.25℃时,浓度均为0.1mol/L的溶液,其pH如下表所示.有关说法正确的是( )
| 序号 | ① | ② | ③ | ④ |
| 溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
| pH | 7.0 | 7.0 | 8.1 | 8.4 |
| A. | 酸性强弱:H2CO3>HF | |
| B. | ①和②中溶质均未水解 | |
| C. | 离子的总浓度:①>③ | |
| D. | ④中:c(HCO3-)+2c(CO32-)+c(H2CO3)═0.1 mol/L |
 +2HNO3$→_{100-110℃}^{浓硫酸}$
+2HNO3$→_{100-110℃}^{浓硫酸}$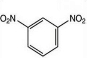 +2H2O.
+2H2O. 与NaOH水溶液共热,生成的有机物的结构简式为
与NaOH水溶液共热,生成的有机物的结构简式为 ;
; ;若该有机物有一个反式异构体,且能与氢气加成生成2-甲基戊烷,则该有机物的结构简式为
;若该有机物有一个反式异构体,且能与氢气加成生成2-甲基戊烷,则该有机物的结构简式为 ;
;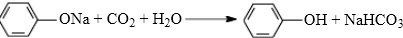 .
.