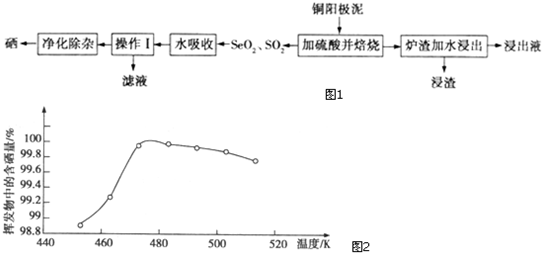
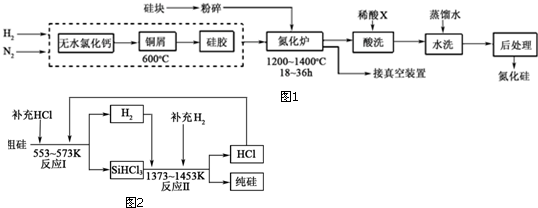
题目内容
7.硝酸工业尾气中氮氧化物(NO与NO2)是主要的大气污染物之一,可用氨氧混合气进行选择性催化还原处理.其主要反应原理如下:4NO+4NH3+O2$→_{140℃}^{催化剂}$4N2+6H2O 6NO2+8NH3$→_{140℃}^{催化剂}$7N2+12H2O
某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4:1.设尾气中氮氧化物与氨氧混合气恰好完全反应.
(1)尾气中氮氧化合物的平均相对分子质量为33.2.
(2)尾气中NO的含量为1800mg/m3.
(3)要处理5m3的尾气,计算需要氨氧混合气的体积10.64L.
(4)另一种处理氮氧化物的方法是用烧碱进行吸收,反应为:
2NO2+2NaOH→NaNO2+NaNO3+H2O; NO+NO2+2NaOH→2NaNO2+H2O
现有另一硝酸厂的尾气试样,其中含0.5mol氮氧化物,用一定体积的25% NaOH溶液(密度1,.28g/cm3)恰好完全吸收.
①NaOH溶液的物质的量浓度为8mol/L,体积为62.5mL.
②已知反应后溶液中含有0.35mol NaNO2.若将尾气中NO与NO2的平均组成记为NOx,计算x的值.
分析 (1)先根据尾气中二氧化氮和一氧化氮的关系计算二氧化氮、一氧化氮的物质的量,再根据方程式计算氨气和氧气的物质的量,最后根据M=$\frac{m}{n}$计算其平均相对分子质量;(2)根据m=nM计算;
(3)根据V=nVm计算需要氨氧混合气体的体积;
(4)①C=$\frac{1000ρw}{M}$,根据原子守恒知,氮氧化物的物质的量等于氢氧化钠的物质的量,再根据V=$\frac{n}{c}$计算;
②根据方程式2NO2+2NaOH=NaNO2+NaNO3+H2O和NO+NO2+2NaOH=2NaNO2+H2O中氮原子守恒计算NO和NO2的物质的量分别是多少,根据氧原子守恒解答.
解答 解:(1)①设1m3尾气中NO2的物质的量为x,则NO的物质的量为4x,4xmol×30g/mol+46xg=2.49g,x=0.015mol,所以1m3尾气中NO2的物质的量为0.015mol,则NO的物质的量为0.06mol,
根据4NO+4NH3+O2$→_{140℃}^{催化剂}$4N2+6H2O知,0.06molNO需要0.06molNH3,0.015molO2,根据方程式6NO2+8NH3$→_{140℃}^{催化剂}$7N2+12H2O,0.015molNO2需要0.02molNH3,所以氮氧化物混合气体的平均摩尔质量为$\frac{0.015mol×46g/mol+0.06mol×30g/mol}{0.075mol}$=33.2g/mol,所以其相对分子质量为33.2,故答案为:33.2;
(2)1m3尾气中NO的物质的量为0.06mol,所以其m=nM=0.06mol×30g/mol=1800mg,故答案为:1800;
(3)处理1m3尾气需要氨氧混合物的体积=(0.06+0.02+0.015)mol×22.4L/mol=2.128L,则要处理5m3的尾气,需要氨氧混合气的体积为=2.128L×5=10.64L,
故答案为:10.64L;
(3)①C=$\frac{1000×1.28×25%}{40}$,根据原子守恒知,氮氧化物的物质的量等于氢氧化钠的物质的量,所以V=$\frac{0.5mol}{8mol/L}$=62.5mL,故答案为:8;62.5;
②2NO2+2NaOH=NaNO2+NaNO3+H2O和NO+NO2+2NaOH=2NaNO2+H2O,根据氮原子守恒知,生成0.35mol亚硝酸钠则生成0.15mol硝酸钠,生成0.15mol硝酸钠需要0.3mol二氧化氮,同时生成0.15mol亚硝酸钠,0.2mol亚硝酸钠需要0.1mol一氧化氮,所以二氧化氮的物质的量是0.4mol,根据氧原子守恒得x=$\frac{0.1×1+0.4×2}{0.5}$=1.8,
答:x为1.8.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中物质的量关系、物质的量的基本计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.

 名校通行证有效作业系列答案
名校通行证有效作业系列答案| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O CO2 | ||
| C. | CaCl2 NaOH H2O | D. | NH3 H2O CO2 |
| A. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| B. | 水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷 | |
| C. | 胶体与其它分散系的本质区别是胶体有丁达尔效应,而其它分散系却没有 | |
| D. | 纳米材料 微粒直径从几纳米到几十纳米(1nm=10-9m),因此纳米材料属于胶体 |
| A. | 燃放烟花爆竹 | B. | 为城市主干道洒水保洁 | ||
| C. | 大面积开发土建项目 |
| A. | 元素非金属性由强到弱的顺序是:Z>Y>X | |
| B. | Y元素最高价氧化物对应水化物的化学式可表示为H4YO4 | |
| C. | 3种元素的气态氢化物中,Z的气态氢化物最稳定 | |
| D. | 原子半径由大到小的顺序为 Z>Y>X |
| A. | 0.45mol | B. | 0.8mol | C. | 0.6mol | D. | 0.4mol |
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是A.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡向右(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将减小(填“增大”、“减小”或“无法确定”).
(3)相同条件下,取等体积的甲、乙两溶液,各稀释100倍.稀释后的溶液,其pH大小关系为:pH(甲)>pH(乙)( 填“>”、“<”或“=”).
(4)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)< V(乙)( 填“>”、“<”或“=”).
(5)已知25℃时,两种酸的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
| K2 | -- | 5.6×10-11 | -- |
A.HCO3- B.CO32- C.ClO- D.CH3COO-
写出下列反应的离子方程式:CH3COOH+Na2CO3(少量):2CH3COOH+CO32-=H2O+2CH3COO-+CO2↑;HClO+Na2CO3(少量):HClO+CO32-=ClO-+HCO3-.