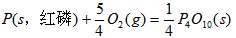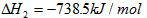题目内容
(1)P4(s,白磷)+5O2(g)=P4O10(s)△H1=-2983.2kJ/mol(2)P(s,红磷)+
O2(g)=
P4O10(s)△H2=-738.5kJ/mol,则白磷转化为红磷的热化学方程式
| 5 |
| 4 |
| 1 |
| 4 |
P4(s,白磷)=4P(s,红磷)△H=-29.2kJ/mol,
P4(s,白磷)=4P(s,红磷)△H=-29.2kJ/mol,
.相同的状况下,能量较低的是红磷
红磷
;白磷的稳定性比红磷低
低
(填“高”或“低”).分析:根据盖斯定律写出白磷转化为红磷的热化学方程式,根据物质的总能量与反应热的关系判断,能量越高物质越稳定.
解答:解:P4(s,白磷)+5O2(g)=P4O10(s)△H1=-2983.2kJ/mol…①
P(s,红磷)+
O2(g)=
P4O10(s)△H2=-738.5kJ/mol,…②
根据盖斯定律:①-②×4可得:P4(s,白磷)=4P(s,红磷)△H=(-2983.2kJ/mol)-(-738.5kJ)×4=-29.2kJ/mol,说明白磷转化为红磷是放热反应,相同的状况下,红磷能量比白磷低,红磷比白磷稳定,故答案为:P4(s,白磷)=4P(s,红磷)△H=-29.2kJ/mol;红磷;低.
P(s,红磷)+
| 5 |
| 4 |
| 1 |
| 4 |
根据盖斯定律:①-②×4可得:P4(s,白磷)=4P(s,红磷)△H=(-2983.2kJ/mol)-(-738.5kJ)×4=-29.2kJ/mol,说明白磷转化为红磷是放热反应,相同的状况下,红磷能量比白磷低,红磷比白磷稳定,故答案为:P4(s,白磷)=4P(s,红磷)△H=-29.2kJ/mol;红磷;低.
点评:本题考查反应热的计算,题目难度不大,注意盖斯定律的应用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 O2(g)=
O2(g)= P4O10(s)△H2=-738.5kJ/mol,则白磷转化为红磷的热化学方程式 .相同的状况下,能量较低的是 ;白磷的稳定性比红磷 (填“高”或“低”).
P4O10(s)△H2=-738.5kJ/mol,则白磷转化为红磷的热化学方程式 .相同的状况下,能量较低的是 ;白磷的稳定性比红磷 (填“高”或“低”).