题目内容
19.在一定温度下,将一包白色无水硫酸铜粉末投入到150g蒸馏水中,充分搅拌过滤得到一定质量的蓝色晶体和84g滤液.又知此温度下无水硫酸铜的溶解度为40g,则此包无水硫酸铜的质量是( )| A. | 60 g | B. | 66 g | C. | 90 g | D. | 184 g |
分析 根据饱和溶液中质量分数不变和溶解度计算出剩余饱和溶液中溶质和溶剂的质量,根据硫酸铜晶体组成计算晶体中溶质的质量,两者之和为此包无水硫酸铜的质量.
解答 解:把无水硫酸铜粉末加入150g蒸馏水中,得到一定量的蓝色晶体CuSO4•5H20,剩余溶液仍然是饱和溶液,设剩余溶液中的溶质为xg,
则$\frac{40g}{100g+40g}$=$\frac{xg}{84g}$得:x=24,
结晶水的质量=150g-(84g-24g)=90g,设结晶中硫酸铜的质量为yg,
CuSO4~5H20
160 90
yg 90g
$\frac{160}{90}$=$\frac{yg}{90g}$,
y=160,此包无水硫酸铜的质量为=160g+24g=184g.
故选D.
点评 本题考查质量守恒定律,质量分数的计算,难度中等,解题时注意守恒思想的运用.

练习册系列答案
相关题目
9.工业制备硫酸过程中存在如下反应:2SO2+O2$?_{催化剂}^{450-500℃}$2SO3,下列关于该反应的说法正确的是( )
| A. | 增大O2的浓度能加快反应速率 | B. | 降低体系温度能加快反应速率 | ||
| C. | 使用催化剂不影响反应速率 | D. | 一定条件下SO2能100%转化为SO3 |
10.下列实验或实验过程符合“绿色化学”原则的是( )
| A. | 用溴水代替碘水进行萃取实验 | |
| B. | 用过量的氯气进行性质实验 | |
| C. | 用乙烯和氧气在银作催化剂的条件下制备环氧乙烷 | |
| D. | 用铜粉代替铜丝进行铜和浓硝酸反应的实验 |
7.下列化学反应的离子方程式能用通式:mM(n+1)++nN═mM+nN(m+1)+表示的是( )
| A. | 氯化锌溶液中投入钠 | B. | 氯化铁溶液中投入铜 | ||
| C. | 硝酸银溶液中投入铜 | D. | 硫酸铜溶液中投入铁 |
14.氢元素有三种同位素:H、D、T,氯元素有两种同位素${\;}_{17}^{35}$Cl、${\;}_{17}^{37}$Cl,当用一种仪器测定由氢、氯两种元素原子组成的HCl分子的质量,所得到的数值有( )
| A. | 2种 | B. | 5种 | C. | 6种 | D. | 9种 |
4.下列说法不正确的是( )
| A. | 某芳香烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有3种 | |
| B. | 按系统命名法,有机物  的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 | |
| C. | 甲烷、甲醛、尿素都不存在同分异构体 | |
| D. | 某有机物含有C、H、O、N四种元素,其球棍模型为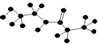 ,该有机物的结构简式为 ,该有机物的结构简式为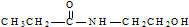 |
8.某学习小组研究“不同条件对化学反应速率影响的研究”,选用4mL0.01mol•L-1KMnO4溶液与2mL0.1mol•L-1H2C2O4溶液在稀硫酸中进行实验,改变条件如表:
(1)如果研究催化剂对化学反应速率的影响,使用实验①和②(用①-④表示,下同);如果研究温度对化学反应速率的影响,使用实验①和③.
(2)对比实验①和④,可以研究草酸的浓度或反应物的浓度对化学反应速率的影响,实验④中加入1mL蒸馏水的目的是确保①和④组对比实验中c(KMnO4)不变,或确保溶液总体积不变.
(1)如果研究催化剂对化学反应速率的影响,使用实验①和②(用①-④表示,下同);如果研究温度对化学反应速率的影响,使用实验①和③.
(2)对比实验①和④,可以研究草酸的浓度或反应物的浓度对化学反应速率的影响,实验④中加入1mL蒸馏水的目的是确保①和④组对比实验中c(KMnO4)不变,或确保溶液总体积不变.
| 组别 | 草酸的体积/mL | 温度/℃ | 其它物质 |
| ① | 2mL | 20 | |
| ② | 2mL | 20 | 2滴饱和MnSO4溶液 |
| ③ | 2mL | 30 | |
| ④ | 1mL | 20 | 1mL蒸馏水 |
 .水合氢离子的结构式:
.水合氢离子的结构式: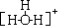 .
.