题目内容
16.下列关于物质所属类别的叙述中错误的是( )| A. | Al2O3属于两性氧化物 | B. | 胆矾(CuSO4•5H2O)属于纯净物 | ||
| C. | NaHCO3属于强电解质 | D. | 纯碱属于碱 |
分析 A.既可以与酸反应生成盐和水又可以与碱反应生成盐和水的氧化物;
B.只有一种物质的为纯净物;
C.在水溶液中能完全电离的为强电解质;
D.电离产生阴离子都是氢氧根离子的为碱.
解答 解:A.氧化铝既能与盐酸又能与氢氧化钠溶液反应,生成产物都是盐和水,属于两性氧化物,故A正确;
B.胆矾(CuSO4•5H2O)只含有一种物质,属于纯净物,故B正确;
C.碳酸氢钠在水中完全电离出钠离子和碳酸氢根离子,属于强电解质,故C正确;
D.纯碱为碳酸钠,电离产生的阴离子为碳酸根离子,属于盐,故D错误;
故选:D.
点评 本题考查了物质的分类,明确 两性氧化物、纯净物、强电解质、碱的概念是解题关键,题目难度不大.

练习册系列答案
 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
19.下列有关电解质溶液的说法正确的是( )
| A. | 浓度均为0.1 mol•L-1的①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为:③<②<① | |
| B. | 工业上常用Na2SO3溶液作为吸收液脱除烟气中的SO2,随着SO2的吸收,吸收液的pH不断变化.当吸收液呈酸性时:c (Na+)=c (SO32-)+c (HSO3-)+c (H2SO3) | |
| C. | 常温下,将0.1 mol•L-1 CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大到原来的100倍 | |
| D. | 向0.2 mol/LNaHCO3溶液中加入等体积0.1 mol/L NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
20.根据下列实验操作和现象所得到的结论正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多孔的海绵状 | 浓硫酸具有吸水性和强氧化性 |
| B | 将0.1mol/LMgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol/LCuSO4溶液 | 先有白色沉淀生成后变为浅蓝色沉淀 | Cu(OH)2的溶解度比Mg(OH)2的小 |
| C | FeCl3和BaCl2混合溶液中通入足量SO2 | 溶液变为浅绿色且有白色沉淀生成 | Fe3+被还原为Fe2+,沉淀为BaSO3 |
| D | 常温下,将铁片浸入足量浓硫酸中 | 铁片上无明显现象 | 常温下,铁与浓硫酸没有发生化学反应 |
| A. | A | B. | B | C. | C | D. | D |
4.下列装置,操作正确的是( )
| A. |  用图装置加热氯化铵溶液制取氯化铵晶体 | |
| B. | 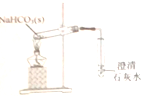 用图装置探究NaHCO3的热稳定 | |
| C. | 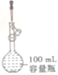 用图装置溶解氯化钠配制100mL1mol•L-1NaCl溶液 | |
| D. |  用图装置比较硫、碳、硅三种元素的非金属性强弱 |
11.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | ${\;}_{17}^{35}$Cl与 ${\;}_{17}^{37}$Cl得电子能力不相同 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | Cl-、S2-、Ca2+、K+半径逐渐减小 | |
| D. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
1.关于有机物的下列说法错误的是( )
| A. | 烯烃的系统命名法要求选择含有碳碳双键的最长碳链为主链 | |
| B. | 利用质谱仪可以测定有机物的相对分子质量 | |
| C. | 淀粉和纤维素的通式相同,但不是同分异构体 | |
| D. | 油脂都是由高级脂肪酸和甘油形成的酯,它们都是固态不溶于水的物质 |
8.利用“对角线规则”,有关Li、Be、B及其化合物的叙述中,不正确的是( )
| A. | 将20mL0.1mol/L氯化锂溶液和20mL0.1mol/LNa2CO3溶液混合后,观察到有白色沉淀生成 | |
| B. | 硼的最高价氧化物对应的水化物是硼酸,硼酸属于弱酸 | |
| C. | Be(OH)2既能溶于强酸,又能溶于强碱溶液 | |
| D. | Be属于金属,Be能与盐酸反应产生氢气,但不能与NaOH溶液反应 |
5.Mg-AgCl电池是一种以海水为电解质溶液的水激活电池.下列叙错误的是( )
| A. | 负极反应式为Mg-2e-=Mg2+ | |
| B. | 正极反应式为Ag+e-=Ag | |
| C. | 电池放电时Cl-由正极向负极迁移 | |
| D. | 电池放电时,外电路中,电子由负极向正极移动 |
8.现有三种可溶物质A、B、C,其中A、B是盐,一种是酸式盐,一种是正盐,C是碱,它们溶于水后电离产生的所用离子如表所示:
请根据下列叙述回答问题:
(1)C的化学式为Ba(OH)2.
(2)A溶液与B溶液反应可生成气体X,则X的化学式为CO2,该反应的化学方程式为2NaHSO4+Na2CO3=2Na2SO4+CO2↑+H2O.
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸.
①B的化学式为NaHSO4,鉴别溶液中B的阴离子的方法是先加入盐酸再加入BaCl2溶液,若有白色沉淀生成,则证明溶液中有SO42-.
②D溶于稀硝酸的离子方程式为2H++BaCO3=Ba2++CO2↑+H2O.
| 阳离子 | Na+、H+、Ba2+ |
| 阴离子 | OH-、CO32-、SO42- |
(1)C的化学式为Ba(OH)2.
(2)A溶液与B溶液反应可生成气体X,则X的化学式为CO2,该反应的化学方程式为2NaHSO4+Na2CO3=2Na2SO4+CO2↑+H2O.
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸.
①B的化学式为NaHSO4,鉴别溶液中B的阴离子的方法是先加入盐酸再加入BaCl2溶液,若有白色沉淀生成,则证明溶液中有SO42-.
②D溶于稀硝酸的离子方程式为2H++BaCO3=Ba2++CO2↑+H2O.