题目内容
A、B、C、D、E是原子序数依次增大的短周期元素,A是短周期中金属性最强的元素,B是地壳中含量最高的金属元素,C单质的晶体是良好的半导体材料,D的最外层电子数与内层电子数之比为3:5.
(1)C的原子结构示意图为 ,D在元素周期表中的位置
(2)A单质在氧气中燃烧生成化合物甲,甲中所含化学键为 ;A单质在E单质中燃烧生成化合物乙,用电子式表示乙的形成过程 .
(3)F是中学化学常见元素,它的一种氧化物为红棕色粉末,B单质与其在高温条件下反应是冶炼F单质的方法之一,该反应的化学方程式为 .
(4)含B元素的化合物常用作净水剂,用文字和化学用语解释净水原因: .
(5)E元素的非金属性强于D元素,用原子结构解释原因:同周期元素随着原子序数的递增, ,非金属性增强.
(6)工业上将干燥的E单质通人D熔融的单质中可制得化合物D2E2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,该反应的化学方程式为 .
(1)C的原子结构示意图为
(2)A单质在氧气中燃烧生成化合物甲,甲中所含化学键为
(3)F是中学化学常见元素,它的一种氧化物为红棕色粉末,B单质与其在高温条件下反应是冶炼F单质的方法之一,该反应的化学方程式为
(4)含B元素的化合物常用作净水剂,用文字和化学用语解释净水原因:
(5)E元素的非金属性强于D元素,用原子结构解释原因:同周期元素随着原子序数的递增,
(6)工业上将干燥的E单质通人D熔融的单质中可制得化合物D2E2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,该反应的化学方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E是原子序数依次增大的短周期元素,A是短周期中金属性最强的元素,则A是钠元素,B是地壳中含量最高的金属元素,则B是铝元素,C单质的晶体是良好的半导体材料,则C为硅元素,D的最外层电子数与内层电子数之比为3:5,则D为硫元素,则E为氯元素,F是中学化学常见元素,它的一种氧化物为红棕色粉末,B单质与其在高温条件下反应是冶炼F单质的方法之一,该反应为铝热反应,则F为铁元素,据此答题.
解答:
解:A、B、C、D、E是原子序数依次增大的短周期元素,A是短周期中金属性最强的元素,则A是钠元素,B是地壳中含量最高的金属元素,则B是铝元素,C单质的晶体是良好的半导体材料,则C为硅元素,D的最外层电子数与内层电子数之比为3:5,则D为硫元素,则E为氯元素,F是中学化学常见元素,它的一种氧化物为红棕色粉末,B单质与其在高温条件下反应是冶炼F单质的方法之一,该反应为铝热反应,则F为铁元素,
(1)C为硅元素,C的原子结构示意图为 ,D为硫元素,D在元素周期表中的位置是第3周期,第VIA族,
,D为硫元素,D在元素周期表中的位置是第3周期,第VIA族,
故答案为: ;第3周期,第VIA族;
;第3周期,第VIA族;
(2)钠单质在氧气中燃烧生成化合物甲为过氧化钠,甲中所含化学键为离子键、非极性共价键;钠单质在氯气中燃烧生成化合物乙为氯化钠,用电子式表示乙的形成过程为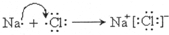 ,
,
故答案为:离子键、非极性共价键; ;
;
(3)铝单质与氧化铁在高温条件下反应是冶炼铁的方法之一,该反应的化学方程式为Fe2O3+2Al
2Fe+Al2O3,
故答案为:Fe2O3+2Al
2Fe+Al2O3;
(4)B是铝元素,含B元素的化合物常用作净水剂,因为铝离子能水解生氢氧化铝胶体,能吸附水中悬浮物,使之凝聚达到净水目的,反应的离子方程式为Al3+﹢3H2O Al(OH)3﹢3H+,
Al(OH)3﹢3H+,
故答案为:铝离子能水解生氢氧化铝胶体,能吸附水中悬浮物,使之凝聚达到净水目的,反应的离子方程式为Al3+﹢3H2O Al(OH)3﹢3H+;
Al(OH)3﹢3H+;
(5)氯元素的非金属性强于硫元素,用原子结构解释原因:同周期元素随着原子序数的递增,原子半径递减,得电子能力增强,非金属性增强,
故答案为:原子半径递减,得电子能力增强;
(6)工业上将干燥的E单质通人D熔融的单质中可制得化合物为S2Cl2,该物质可与水反应生成一种能使品红溶液褪色的气体为SO2,0.2mol该物质参加反应时转移0.3mol电子,则1molS2Cl2参加反应要转移1.5mol电子,其中只有一种元素化合价发生改变,则应为硫元素的化合价在改变,该反应的化学方程式为2S2Cl2﹢2H2O=3S+SO2↑+4HCl,
故答案为:2S2Cl2﹢2H2O=3S+SO2↑+4HCl.
(1)C为硅元素,C的原子结构示意图为
 ,D为硫元素,D在元素周期表中的位置是第3周期,第VIA族,
,D为硫元素,D在元素周期表中的位置是第3周期,第VIA族,故答案为:
 ;第3周期,第VIA族;
;第3周期,第VIA族; (2)钠单质在氧气中燃烧生成化合物甲为过氧化钠,甲中所含化学键为离子键、非极性共价键;钠单质在氯气中燃烧生成化合物乙为氯化钠,用电子式表示乙的形成过程为
 ,
,故答案为:离子键、非极性共价键;
 ;
; (3)铝单质与氧化铁在高温条件下反应是冶炼铁的方法之一,该反应的化学方程式为Fe2O3+2Al
| ||
故答案为:Fe2O3+2Al
| ||
(4)B是铝元素,含B元素的化合物常用作净水剂,因为铝离子能水解生氢氧化铝胶体,能吸附水中悬浮物,使之凝聚达到净水目的,反应的离子方程式为Al3+﹢3H2O
 Al(OH)3﹢3H+,
Al(OH)3﹢3H+,故答案为:铝离子能水解生氢氧化铝胶体,能吸附水中悬浮物,使之凝聚达到净水目的,反应的离子方程式为Al3+﹢3H2O
 Al(OH)3﹢3H+;
Al(OH)3﹢3H+;(5)氯元素的非金属性强于硫元素,用原子结构解释原因:同周期元素随着原子序数的递增,原子半径递减,得电子能力增强,非金属性增强,
故答案为:原子半径递减,得电子能力增强;
(6)工业上将干燥的E单质通人D熔融的单质中可制得化合物为S2Cl2,该物质可与水反应生成一种能使品红溶液褪色的气体为SO2,0.2mol该物质参加反应时转移0.3mol电子,则1molS2Cl2参加反应要转移1.5mol电子,其中只有一种元素化合价发生改变,则应为硫元素的化合价在改变,该反应的化学方程式为2S2Cl2﹢2H2O=3S+SO2↑+4HCl,
故答案为:2S2Cl2﹢2H2O=3S+SO2↑+4HCl.
点评:本题考查结构性质位置关系应用,难度中等,推断元素是解题关键,注意常见元素的自然存在以及元素的性质和基础知识的掌握

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目
下列关于化学反应的限度的说法中,正确的是( )
| A、当可逆反应进行到平衡状态时,正向反应速率和逆向反应速率都为零 |
| B、平衡状态是一种静止的状态,因为反应物和生成物浓度都不再改变 |
| C、化学反应的限度不可以通过改变反应条件而改变 |
| D、当可逆反应达到平衡时,这个反应达到最大限度 |
化学反应SO2+H2O+HNO3═H2SO4+NO经配平后,还原剂的化学计量数为( )
| A、1 | B、2 | C、3 | D、4 |



 ,模仿如图所示流程图设计合成路线,标明每一步的反应物及反应条件.(有机物写结构简式,其它原料自选)
,模仿如图所示流程图设计合成路线,标明每一步的反应物及反应条件.(有机物写结构简式,其它原料自选) 科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,产出高热值的煤炭气,主要成分是CO和H2.
科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,产出高热值的煤炭气,主要成分是CO和H2.