题目内容
5.H2与ICl的反应分①、②两步进行,其能量曲线如下图所示,下列有关说法错误的是( )
| A. | 反应①、反应②均为放热反应 | |
| B. | 反应①、反应②均为氧化还原反应 | |
| C. | 反应①比反应②的速率慢,与相应正反应的活化能无关 | |
| D. | 反应①、反应②的焓变之和为△H=-218kJ•mol-1 |
分析 A.根据反应①、②中反应物与生成物总能量大小分析;
B.反应①中氢气为反应物、反应②中生成了碘单质,说明两个反应中都有化合价变化;
C.反应速率与活化能大小有关;
D.根据图象曲线变化及盖斯定律进行判断.
解答 解:A.根据图象可知,反应①和反应②中反应物总能量都大于生成物,则反应①、反应②均为放热反应,故A正确;
B.反应①中氢气参与反应,反应产物中都是化合物,则一定存在化合价变化,反应②中反应物都是化合物,生成物中有碘单质生成,则也一定存在化合价变化,所以反应①②剩余氧化还原反应,故B正确;
C.反应①比反应②的速率慢,说明反应①中正反应的活化能较小,反应②中正反应的活化能较大,故C错误;
D.反应①、反应②总的能量变化为218kJ,根据盖斯定律可知,反应①、反应②的焓变之和为△H=-218kJ•mol-1,故D正确;
故选C.
点评 本题考查了化学反应与能量变化,题目难度不大,明确反应热与反应物、生成物总能量的关系为解答关键,注意掌握盖斯定律的内容及应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
15.下列说法中正确的是( )
| A. | 发酵粉中主要含有氢氧化钠,能使焙制出的糕点疏松多孔 | |
| B. | 碘盐中的碘可以直接用淀粉检验 | |
| C. | 硫酸氢钠属于盐类,其水溶液显中性 | |
| D. | 碳酸氢钠可以用于治疗胃酸过多 |
20.关于等物质的量的12C和14C的叙述中正确的是( )
①含有相同数目的原子;②含有相同物质的量的质子;③属于同种元素;④具有相同的质量;⑤中子数相等;⑥电子数相等;⑦与氧气完全反应生成CO2时,消耗氧气的量相同;⑧几乎相同的化学性质.
①含有相同数目的原子;②含有相同物质的量的质子;③属于同种元素;④具有相同的质量;⑤中子数相等;⑥电子数相等;⑦与氧气完全反应生成CO2时,消耗氧气的量相同;⑧几乎相同的化学性质.
| A. | 只有②③⑤ | B. | 只有 ①②③ | C. | 除④、⑤外均正确 | D. | 全部正确 |
10. 火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.
火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.
已知:N2H4(l)+O2(g)═N2(g)+2H2O(g)△H=-534kJ•mol-1
H2O2(l)═H2O(l)+$\frac{1}{2}$O2(g)△H=-98kJ•mol-1
H2O(l)═H2O(g)△H=44kJ•mol-1
(1)试写出N2H4和液态H2O2反应生成气态水的热化学方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-642kJ•mol-1.
(2)化学键的键能是指气态原子间形成1mol化学键时释放的能量.下表列出了某些
化学键的键能:
请回答下列问题:
①如图表示某反应的能量变化关系图,此反应为放热(填“放热”或“吸热”)反应,其中△H=(C-D)kJ•mol-1(用含C和D的字母表示);
②若此能量变化关系图表示如下反应:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,则B=926kJ•mol-1,x=496.4.
 火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.
火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.已知:N2H4(l)+O2(g)═N2(g)+2H2O(g)△H=-534kJ•mol-1
H2O2(l)═H2O(l)+$\frac{1}{2}$O2(g)△H=-98kJ•mol-1
H2O(l)═H2O(g)△H=44kJ•mol-1
(1)试写出N2H4和液态H2O2反应生成气态水的热化学方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-642kJ•mol-1.
(2)化学键的键能是指气态原子间形成1mol化学键时释放的能量.下表列出了某些
化学键的键能:
| 化学键 | H-H | O=O | O-H |
| 键能 (kJ•mol-1) | 436 | x | 463 |
①如图表示某反应的能量变化关系图,此反应为放热(填“放热”或“吸热”)反应,其中△H=(C-D)kJ•mol-1(用含C和D的字母表示);
②若此能量变化关系图表示如下反应:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1,则B=926kJ•mol-1,x=496.4.
3.下列说法正确的是( )
| A. | 二氧化硅溶于水显酸性,所以二氧化硅属于酸性氧化物 | |
| B. | 二氧化硅是酸性氧化物,它不溶于任何酸 | |
| C. | 二氧化碳通入水玻璃可以得到硅酸 | |
| D. | 因为高温时二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强 |
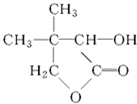 G的合成路线如图:
G的合成路线如图: