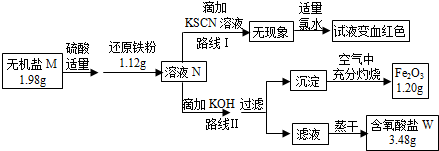
题目内容
12. Cl2及其化合物在生产、生活中有广泛用途,回答下列问题.
Cl2及其化合物在生产、生活中有广泛用途,回答下列问题.(1)氯气溶于水得到氯水,氯水中含有氯元素并且具有氧化性的微粒有Cl2、HClO、ClO-.
(2)新制氯水体系中,存在多个含氯元素之间的平衡关系,请写出任意两个平衡关系:Cl2(aq)+H2O
 HClO+H++Cl-或Cl2(aq)+H2O
HClO+H++Cl-或Cl2(aq)+H2O HClO+HCl、HClO
HClO+HCl、HClO H++ClO-.
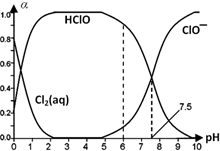
H++ClO-.(3)25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-三种微粒分别所占分数(α)随pH变化的关系如图所示.
已知HClO的杀菌能力比ClO-强,由图分析,用氯气处理饮用水时,pH=7.5与pH=6时杀菌效果较强的是pH=6.
(4)ClO2是一种更高效的杀菌消毒剂,工业上可用电解法制备ClO2,方法如下:在80℃时电解氯化钠饱和溶液得到NaClO3,然后与盐酸反应得到ClO2.电解时,产生ClO3-的电极是阳极极,生成ClO3-的电极反应式为Cl--6e-+3H2O=6H++ClO3-.
(5)已知PCl5的热分解反应为:PCl5(g)?PCl3(g)+Cl2(g),某温度下,在固定容积为10.0L的密闭容器中充入2.00mol PCl5,达到平衡后,测得容器内PCl3的浓度为0.15mol/L.
①上述反应达到平衡后继续向容器充入PCl5,则上述平衡将逆向移动(填“正向”、“逆向”或“不”),PCl5的转化率将减小(填“增大”、“减小”或“不变”).
②计算该温度下PCl5(g)?PCl3(g)+Cl2(g)的平衡常数K(写出计算过程).
分析 (1)氯气溶于水,部分与水反应生成氯化氢和次氯酸,次氯酸部分电离,氯化氢完全电离,结合氯元素化合价判断;
(2)氯气溶于水,部分与水反应生成氯化氢和次氯酸,次氯酸部分电离生成氢离子与次氯酸根离子;
(3)次氯酸具有强的氧化性,具有杀菌消毒作用,依据图中数据分析;
(4)电解氯化钠饱和溶液得到NaClO3,氯离子被氧化生成氯酸根离子,发生氧化反应,电解池中阳极发生氧化反应;
(5)①在保持容器体积不变的条件下,再充入PCl5,等效增大压强,平衡向体积减小的方向移动;
②根据三段式计算平衡时各组分的浓度,代入平衡常数表达式计算.
解答 解:(1)氯气溶于水,部分与水反应生成氯化氢和次氯酸,次氯酸部分电离,氯化氢完全电离,所以氯水中含有氯元素并且具有氧化性的微粒,Cl2、HClO、ClO-中氯元素化合价都可以降价,都具有氧化性;
故答案为:Cl2、HClO、ClO-;
(2)氯气溶于水,部分与水反应生成氯化氢和次氯酸,方程式:Cl2(aq)+H2O


故答案为:Cl2(aq)+H2O


(3)次氯酸具有强的氧化性,具有杀菌消毒作用,依据图数据可知pH=6时,次氯酸含量较高,所以杀菌效果较强;
故答案为:6;
(4)电解氯化钠饱和溶液得到NaClO3,氯离子被氧化生成氯酸根离子,发生氧化反应,电解池中阳极发生氧化反应,电解氯化钠溶液时,阳极上氯离子失电子和水反应生成氯酸根离子和氢离子,电极反应式为:Cl--6e-+3 H2O=6H++ClO3-;
故答案为:阳;Cl--6e-+3 H2O=6H++ClO3-;
(5)①在保持容器体积不变的条件下,再充入PCl5,等效增大压强,平衡向体积减小的方向移动,反应物转化率减小;
故答案为:逆向,减小;
②PCl5(g)  PCl3 (g)+Cl2(g)
PCl3 (g)+Cl2(g)
起始浓度(mol/L) 0.20 0 0
转化浓度(mol/L) 0.15 0.15 0.15
平衡浓度(mol/L) 0.05 0.15 0.15
由K=$\frac{{c(PC{l_3})×c(C{l_2})}}{{c(PC{l_5})}}$=$\frac{0.15mol/L×0.15mol/L}{0.05mol/L}$=0.45mol/L;
故答案为:0.45mol/L.
点评 本题为综合题,考查了氯水的成分及性质、电解反应式的书写、化学平衡移动方向判断及化学平衡常数计算,明确物质的性质及电解池工作原理、化学平衡常数表达式是解题关键,题目难度中等.

| A. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| B. | 陶瓷、水泥和光导纤维均属于硅酸盐材料 | |
| C. | “煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气 | |
| D. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性都是化学变化 |
| A. | 闻化学药品的气味时都不能使鼻子凑近药品 | |
| B. | 点燃氢气前要检查纯度,以免发生爆炸 | |
| C. | 在盛O2集气瓶中进行铁丝燃烧实验时,事先在集气瓶底铺上一层沙子 | |
| D. | 凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂 |
| A. | 铝条放人浓硫酸中 | B. | 漂粉精在空气中长期放置 | ||
| C. | 水蒸汽通过Na2O2粉末 | D. | 烧碱在空气中长期放置 |
| A. | SO2为原子晶体,CO2为分子晶体 | |
| B. | 中心原子采取的杂化方式:SO2为sp2杂化,CO2为sp杂化 | |
| C. | 都是直线形结构 | |
| D. | S原子和C原子上都没有孤电子对 |
| A. | 由于碳燃烧可能生成CO和CO2,所以碳的燃烧热大小与生成产物有关 | |
| B. | 101kPa时,2gH2完全燃烧生成液态水时放热285.8kJ,表示氢气燃烧热的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| C. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ/mol,则含40.0 g NaOH的稀溶液与足量浓硫酸反应放热57.3 kJ | |
| D. | 已知C(石墨,s)=C(金刚石,s)△H>0,则石墨比金刚石稳定 |
| A. | 1-溴丙烷与氢氧化钾的乙醇溶液共热:CH3CH2CH2Br+KOH$→_{△}^{乙醇}$CH3CH2CH2OH+KBr | |
| B. | 将乙酸乙酯、H218O和稀硫酸充分混合并加热:CH3COOCH2CH3+H218O$→_{△}^{稀硫酸}$CH3COOH+CH3CH218OH | |
| C. | 用食醋除去水瓶里的水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| D. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH$→_{△}^{水浴}$CH3COO-+NH4++3NH3+2Ag↓+H2O |