题目内容
3.今有七种物质:①铝片 ②KNO3 ③氯气 ④NaCl晶体 ⑤液态氯化氢 ⑥石灰水 ⑦乙醇,属于电解质的是②④⑤,属于非电解质的是⑦.分析 电解质是指在水溶液里或熔融状态下能导电的化合物,包括酸、碱、盐、活泼金属氧化物和水;
非电解质是在水溶液里和熔融状态下都不能导电的化合物,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等);
单质和混合物既不是电解质也不是非电解质.
解答 解:①铝片是单质,既不是电解质也不是非电解质;
②KNO3 在水溶液里或熔融状态下能导电的化合物,是电解质;
③氯气是单质,既不是电解质也不是非电解质;
④NaCl晶体 在水溶液里或熔融状态下能导电的化合物,是电解质;
⑤液态氯化氢在水溶液里能导电的化合物,是电解质;
⑥石灰水是混合物,既不是电解质也不是非电解质;
⑦乙醇在水溶液里和熔融状态下都不能导电的化合物,是非电解质;
所以:属于电解质的是②④⑤,
属于非电解质的是⑦;
故答案为:②④⑤;⑦.
点评 本题考查了电解质、非电解质判断,明确电解质、非电解质概念是解题关键,注意电解质、非电解质必须是化合物,题目难度不大.

练习册系列答案
相关题目
9.化学与新型材料、环境保护、能源开发等密切相关.下列说法正确的是( )
| A. | 人造纤维、合成橡胶和光导纤维都属于有机高分子化合物 | |
| B. | 推广燃煤发电,停建核电站,以防核泄漏事故发生 | |
| C. | 设计绿色化工工艺,提高反应的选择性和原子利用率 | |
| D. | 棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质 |
11.根据热化学方程式(在101kPa时):S(s)+O2(g)=SO2(g)△H=-297.23kJ/mol 分析下列说法中不正确的是( )
| A. | S的燃烧热为 297.2 kJ/mol | |
| B. | S(g)+O2(g)=SO2(g)放出的热量大于297.2 kJ | |
| C. | S(g)+O2(g)=SO2(g)放出的热量小于297.2 kJ | |
| D. | 形成1 mol SO 2中的化学键所释放的总能量大于断裂1 mol S(s)和1 mol O2(g)中的化学键所吸收的总能量 |
18.下列实验或现象能证明某硫酸铝溶液中含的杂质一定为Fe3+的是( )
| A. | 加入足量氢氧化钠溶液后产生的浑浊不溶解 | |
| B. | 用pH试纸检验呈弱酸性 | |
| C. | 滴入KSCN溶液后溶液变血红色 | |
| D. | 溶液显浅黄色 |
8.下列物质不属于电解质的是( )
| A. | NaHCO3 | B. | NaOH | C. | HNO3 | D. | Cu |
15.经检测某工厂的酸性废水中所含离子及其浓度如下表所示:
(1)c(H+)=0.01mol/L.
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4•7H2O).
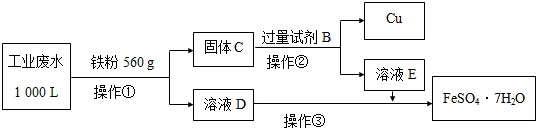
①工业废水中加入铁粉后,反应的离子方程式为:Fe+Cu2+═Fe2++Cu、Fe+2Fe3+═3Fe2+、Fe+2H+═Fe2++H2↑.
②试剂B是H2SO4.
③操作③是蒸发浓缩、冷却结晶、过滤,最后用少量冷水洗涤晶体,在低温下干燥.
④通过检验溶液D中Fe3+来判断废水中Fe3+是否除尽,实验方法是取少量D中溶液于试管中,滴加1滴KSCN溶液,不出现红色,说明废水中Fe3+除尽.
⑤获得的FeSO4•7H2O需密闭保存,原因是FeSO4有还原性,易被氧化(或FeSO4•7H2O失去结晶水).
⑥上述1000L废水经处理,可获得 FeSO4•7H2O的物质的量是12mol.
| 离子 | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
| 浓度/(mol/L) | 2×10-3 | 1×10-3 | 1×10-2 | 2×10-3 |
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4•7H2O).

①工业废水中加入铁粉后,反应的离子方程式为:Fe+Cu2+═Fe2++Cu、Fe+2Fe3+═3Fe2+、Fe+2H+═Fe2++H2↑.
②试剂B是H2SO4.
③操作③是蒸发浓缩、冷却结晶、过滤,最后用少量冷水洗涤晶体,在低温下干燥.
④通过检验溶液D中Fe3+来判断废水中Fe3+是否除尽,实验方法是取少量D中溶液于试管中,滴加1滴KSCN溶液,不出现红色,说明废水中Fe3+除尽.
⑤获得的FeSO4•7H2O需密闭保存,原因是FeSO4有还原性,易被氧化(或FeSO4•7H2O失去结晶水).
⑥上述1000L废水经处理,可获得 FeSO4•7H2O的物质的量是12mol.
13.NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 18g冰中最多含有氢键的数目为4NA | |
| B. | 0.1L3mol•L-1的NH4NO3溶液中含有的NH4+数目为0.3NA | |
| C. | 7.8gNa2O2中阴、阳离子总数为0.4NA | |
| D. | 4.5gSiO2晶体中含有的硅氧键数目为0.3NA |
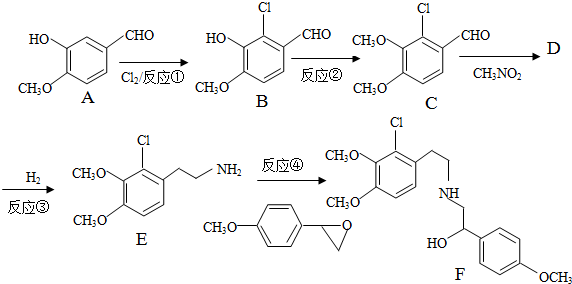
 +H2O
+H2O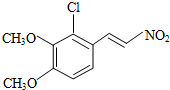 ,反应③中1摩尔D需要4摩尔H2才能转化为E
,反应③中1摩尔D需要4摩尔H2才能转化为E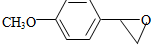 很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式
很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式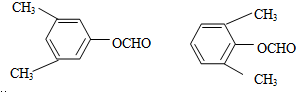 .
. .写出以
.写出以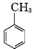 为原料制备
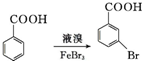
为原料制备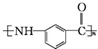 的合成路线流程图(无机试剂任选).(合成路线常用表示方法为:A$→_{反应试剂}^{反应试剂}$B …$→_{反应试剂}^{反应试剂}$目标产物)
的合成路线流程图(无机试剂任选).(合成路线常用表示方法为:A$→_{反应试剂}^{反应试剂}$B …$→_{反应试剂}^{反应试剂}$目标产物)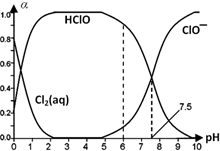 Cl2及其化合物在生产、生活中有广泛用途,回答下列问题.
Cl2及其化合物在生产、生活中有广泛用途,回答下列问题. HClO+H++Cl-或Cl2(aq)+H2O
HClO+H++Cl-或Cl2(aq)+H2O HClO+HCl、HClO
HClO+HCl、HClO H++ClO-.
H++ClO-.