题目内容
17.下列反应中,反应后固体质量减轻的是( )| A. | 铝条放人浓硫酸中 | B. | 漂粉精在空气中长期放置 | ||
| C. | 水蒸汽通过Na2O2粉末 | D. | 烧碱在空气中长期放置 |
分析 A.铝条常温下在浓硫酸中发生钝化,表面生成一薄层致密氧化物薄膜;
B.漂白精主要成分为次氯酸钙,在空气中和二氧化氮、水反应生成碳酸钙和次氯酸,次氯酸见光分解;
C.过氧化钠和水蒸气反应是氢氧化钠和氧气;
D.烧碱在空气中易潮解表面形成溶液,吸收空气中的二氧化碳最后生成生成碳酸钠.
解答 解:A.铝条常温下在浓硫酸中发生钝化,表面生成一薄层致密氧化物薄膜,固体质量增加,故A不符合;
B.漂白精主要成分为次氯酸钙,在空气中和二氧化氮、水反应生成碳酸钙和次氯酸,次氯酸见光分解,Ca(ClO)2+CO2+H2O=CaCO3+↓2HClO,固体从Ca(ClO)2变化为CaCO3,固体质量减小,故B符合;
C.过氧化钠和水蒸气反应是氢氧化钠和氧气,2Na2O2+2H2O=4NaOH+O2,固体2Na2O2变化为4NaOH,固体质量增加,故C不符合;
D.烧碱在空气中易潮解表面形成溶液,吸收空气中的二氧化碳最后生成生成碳酸钠,NaOH变化为Na2CO3,固体质量增加,故D不符合;
故选B.
点评 本题考查了物质性质,物质组成和物质反应前后固体质量变化的计算分析,掌握反应原理和变化特征是解题关键,题目难度中等.

练习册系列答案
相关题目
7.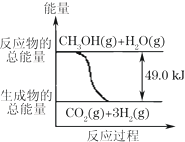 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)→CO2(g)+3H2(g)-49.0kJ
②CH3OH(g)+$\frac{1}{2}$O2(g)→CO2(g)+2H2(g)+192.9kJ
下列说法正确的是( )
 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:①CH3OH(g)+H2O(g)→CO2(g)+3H2(g)-49.0kJ
②CH3OH(g)+$\frac{1}{2}$O2(g)→CO2(g)+2H2(g)+192.9kJ
下列说法正确的是( )
| A. | 1molCH3OH完全燃烧放热192.9kJ | |
| B. | 反应①中的能量变化如右图所示 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$ O2(g)→CO2(g)+2H2(g)+Q的Q<192.9kJ |
8.下列物质不属于电解质的是( )
| A. | NaHCO3 | B. | NaOH | C. | HNO3 | D. | Cu |
2.下列反应中生成物总能量高于反应物总能量的是( )
| A. | 盐酸与NaOH溶液反应 | B. | 碳酸氢铵受热分解 | ||
| C. | 铝粉与MnO2反应 | D. | 氧化钙溶于水 |
9.下列实验操作正确的是( )
| A. | 过滤时用玻璃棒搅拌漏斗里的液体 | |
| B. | 加热后的蒸发皿用坩埚钳夹取 | |
| C. | 用自来水制蒸馏水实验中,将温度计水银球插到蒸烧瓶自来水中 | |
| D. | 从碘水中提取单质碘时,可用无水乙醇代替CCl4 |
6.下列各组物质之间不能发生置换反应的是( )
| A. | 氯水加入溴化钠溶液中 | B. | 用一氧化碳还原三氧化二铁 | ||
| C. | 高温下碳与二氧化硅反应 | D. | 铜丝加入到硝酸银溶液中 |
7.硅酸钠的水溶液俗称“水玻璃”,是建筑行业经常使用的一种黏合剂.硅酸钠属于( )
| A. | 盐 | B. | 氧化物 | C. | 碱 | D. | 酸 |
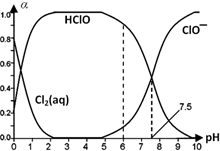 Cl2及其化合物在生产、生活中有广泛用途,回答下列问题.
Cl2及其化合物在生产、生活中有广泛用途,回答下列问题. HClO+H++Cl-或Cl2(aq)+H2O
HClO+H++Cl-或Cl2(aq)+H2O HClO+HCl、HClO
HClO+HCl、HClO H++ClO-.
H++ClO-.