题目内容
6.均为0.5mol•L-1的下列物质的溶液,从常温加热到80℃,其pH没有明显变化的是( )| A. | NaHSO4 | B. | NaOH | C. | CH3COONa | D. | NH4Cl |
分析 A、NaHSO4在溶液中完全电离;
B、氢氧化钠是强碱,在溶液中完全电离;
C、CH3COONa是强碱弱酸盐,在溶液中存在水解平衡;
D、NH4Cl是强酸弱碱盐,在溶液中存在水解平衡.
解答 解:A、NaHSO4在溶液中完全电离为钠离子、氢离子和硫酸根,当加热时,溶液中的氢离子浓度c(H+)几乎不变,即pH不变,故A正确;
B、氢氧化钠是强碱,在溶液中完全电离,当加热时,溶液中的c(OH-)不变,但水的离子积Kw增大,故c(H+)=$\frac{Kw}{c(O{H}^{-})}$增大,故pH变小,故B错误;
C、CH3COONa是强碱弱酸盐,在溶液中存在水解平衡,当加热时,其水解被促进,溶液中的c(OH-)增大,故c(H+)=$\frac{Kw}{c(O{H}^{-})}$会发生变化,即pH会变化,故C错误;
D、NH4Cl是强酸弱碱盐,在溶液中存在水解平衡,当加热时水解被促进,故溶液中的c(H+)增大,则pH变小,故D错误.
故选A.
点评 本题考查溶液的pH,明确pH的计算与溶液中的氢离子的浓度有直接关系是解答本题的关键,并注意温度对盐类水解及弱电解质的电离的影响来解答.

练习册系列答案
相关题目
16.如图是电解熔融 NaCl 制备金属钠的装置示意图,下列有关判断正确的是( )
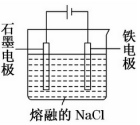

| A. | 通过该装置可以将化学能转化为电能 | |
| B. | 石墨电极为正极 | |
| C. | Na+在铁电极上得到电子被还原为钠 | |
| D. | 电流从负极流出,流入铁电极 |
17.下列指定反应的离子方程式正确的是( )
| A. | 用铁电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 用强碱溶液吸收工业制取硝酸的尾气:NO+NO2+2OH-=2NO${\;}_{3}^{-}$+H2O | |
| C. | 向硫酸铜溶液中加入NaHS溶液生成黑色沉淀:Cu2++HS-=CuS↓+H+ | |
| D. | 向Al2(SO4)3溶液中加入过量氨水:Al3++4NH3•H2O=[Al(OH)4]-+4NH${\;}_{4}^{+}$ |
14.某蓄电池放电、充电的反应式为:Fe+Ni2O3+3H2O $?_{充电}^{放电}$Fe(OH)2+2Ni(OH)2,下列推断中正确的是( )
①放电时,Fe为正极,Ni2O3为负极;
②蓄电池的电极必须浸在某碱性溶液中.
③充电时,阴极上的电极反应式是:Fe(OH)2+2e-═Fe+2OH-;
④充电时,Ni(OH)2为阳极.
①放电时,Fe为正极,Ni2O3为负极;
②蓄电池的电极必须浸在某碱性溶液中.
③充电时,阴极上的电极反应式是:Fe(OH)2+2e-═Fe+2OH-;
④充电时,Ni(OH)2为阳极.
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②④ |
1.化学与生活、社会发展息息相关,下列说法错误的是( )
| A. | “霾尘积聚难见路人”,雾霾所形成的分散系不具有丁达尔效应 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了氧化还原反应 | |
| C. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于物理变化 | |
| D. | 古剑“湛泸”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 |
11.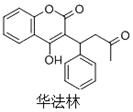 华法林是一种治疗心脑血管疾病的药物,其结构简式如图所示,下列叙述正确的是( )
华法林是一种治疗心脑血管疾病的药物,其结构简式如图所示,下列叙述正确的是( )
 华法林是一种治疗心脑血管疾病的药物,其结构简式如图所示,下列叙述正确的是( )
华法林是一种治疗心脑血管疾病的药物,其结构简式如图所示,下列叙述正确的是( )| A. | 分子中2个苯环一定处于同一平面 | |
| B. | 1mol华法林最多能与2mol NaOH反应 | |
| C. | 在一定条件下,华法林可与HCHO发生缩聚反应 | |
| D. | 在NaOH水溶液中加热,华法林可发生消去反应 |
3.下列属于离子反应的是( )
| A. | H2和O2反应生成水 | B. | 铁片投入稀硫酸中 | ||
| C. | NH4HCO3受热分解 | D. | 向Na2SO4溶液滴加KCl溶液 |