题目内容
向20mL1mol/LH2SO4溶液中加入2OmL1mol/LNaOH溶液,充分反应,下列 说法正确的是( )
| A、溶液中c(OH-)═c(H+),溶液呈中性 |
| B、c(Na+)═c(SO42-)═c(H+) |
| C、H2SO4剩余,溶液呈酸性 |
| D、溶液的导电能力和原H2SO4溶液相同 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:根据H2SO4+2NaOH=Na2SO4+2H2O,结合反应物的物质的量分析,反应产物为Na2SO4溶液,剩余H2SO4溶液,据此分析.
解答:
解:A.有H2SO4溶液剩余,则c(OH-)<c(H+),溶液呈酸性,故A错误;
B.等体积混合则溶液体积增大一倍,即c(Na+)、c(SO42-)减小为原来的一半,即c(Na+)=c(SO42-)═0.5mol/L,反应前c(H+)=2mol/L,消耗了一半,溶液体积增大一倍,则混合后c(H+)=2mol/L×
=0.5mol/L,所以c(Na+)═c(SO42-)═c(H+),故B正确;
C.H2SO4+2NaOH=Na2SO4+2H2O反应中,若H2SO4完全反应需要2倍其物质的量的NaOH,而加入的n(NaOH)=n(H2SO4),所以H2SO4剩余,溶液呈酸性,故C正确;
D.等体积混合,溶液体积增大一倍,则离子浓度降低为原来的一半,导电能力降低,故D错误;
故选BC.
B.等体积混合则溶液体积增大一倍,即c(Na+)、c(SO42-)减小为原来的一半,即c(Na+)=c(SO42-)═0.5mol/L,反应前c(H+)=2mol/L,消耗了一半,溶液体积增大一倍,则混合后c(H+)=2mol/L×
| 1 |
| 4 |
C.H2SO4+2NaOH=Na2SO4+2H2O反应中,若H2SO4完全反应需要2倍其物质的量的NaOH,而加入的n(NaOH)=n(H2SO4),所以H2SO4剩余,溶液呈酸性,故C正确;
D.等体积混合,溶液体积增大一倍,则离子浓度降低为原来的一半,导电能力降低,故D错误;
故选BC.
点评:本题考查酸碱混合时的定性判断,难度不大,应根据化学方程式,根据反应物物质的量判断,混合溶液的酸碱性,是解决这类习题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
对于反应 2H2(g)+O2(g)?2H2O(g);△H=-483.6kJ/mol,下列说法正确的是( )
| A、反应物具有的总能量高于生成物 |
| B、H2的燃烧热△H=-241.8kJ/mol |
| C、破坏H-H键要放出热量 |
| D、升高温度重新达到平衡,平衡常数增大 |
有机物A的结构简式为 ,A的同分异构体中带苯环的化合物(烯醇结构除外)共有( )
,A的同分异构体中带苯环的化合物(烯醇结构除外)共有( )
 ,A的同分异构体中带苯环的化合物(烯醇结构除外)共有( )
,A的同分异构体中带苯环的化合物(烯醇结构除外)共有( )| A、3种 | B、4种 | C、5种 | D、6种 |
下列各图均能表示甲烷的分子结构,哪一种更能反映其真实存在状况( )
A、 甲烷分子结构示意图 |
B、 甲烷分子的电子式 |
C、 球棍模型 |
D、 比例模型 |
常温条件下,一密闭容器中以1:2:3的比例充入NO、N2、NO2,在条件不变的情况下,向容器中充入与NO2等体积的O2,充分反应后,有关容器中的气体的下列叙述中正确的是(不考虑NO2转化为N2O4)( )
| A、NO、N2、NO2、O2的体积比为1:2:3:3 |
| B、N2、NO2、O2的体积比为2:3:2 |
| C、NO、NO2、O2的体积比为4:3:1 |
| D、N2、NO2、O2的体积比为4:8:5 |
充分燃烧3L由甲烷、乙烯和丙炔组成的混合气体,生成7L CO2和4.82g水(气体体积均在标准状况下测定),则原混合气体中甲烷、乙烯和乙炔的体积比可能是( )
| A、1:1:1 |
| B、1:2:3 |
| C、3:2:1 |
| D、3:1:2 |
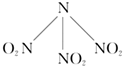 科学家最近研制出可望成为高效火箭推进剂N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法不正确的是( )
科学家最近研制出可望成为高效火箭推进剂N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法不正确的是( )| A、分子中的化学键有极性键和非极性键 |
| B、分子中四个氮原子位于正四面体的顶点 |
| C、该物质的熔、沸点可能比NH3高 |
| D、15.2g该物质含有6.02×1023个原子 |
下列有关氯气的叙述中正确的是( )
| A、氯气在常温下能与铁反应,故不能用铁罐存放液氯 |
| B、液氯和氯水不是同一物质 |
| C、点燃氢气和氯气的混合气体可以制取氯化氢 |
| D、用氯气对生活用水进行消毒的原因是氯气能杀灭细菌 |
下列电离方程式书写不正确的是( )
| A、Al(OH)3?Al3++3OH- |
| B、NaHCO3═Na++HCO3-HCO-3?H++CO32- |
| C、Na2SO4=2Na++SO42- |
| D、HF?H++F- |