题目内容
4.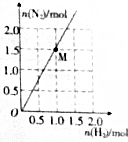 肼是一种优良的贮氢材料,在高温下,N2H4可完全分解为NH3、N2及H2,实验测得分解产物中N2与H2的物质的量的关系如图所示.若该反应中每转移1mol电子吸收30kJ热量,则图中M点时反应吸收的热量为( )
肼是一种优良的贮氢材料,在高温下,N2H4可完全分解为NH3、N2及H2,实验测得分解产物中N2与H2的物质的量的关系如图所示.若该反应中每转移1mol电子吸收30kJ热量,则图中M点时反应吸收的热量为( )| A. | 120kJ | B. | 180kJ | C. | 240kJ | D. | 360kJ |
分析 N2H4可完全分解为NH3、N2及H2,实验测得分解产物中N2与H2的物质的量的关系如图所示,即分解生成的氮气和氢气的物质的量之比为3:2,故可以得出分解的化学方程式为:7N2H4=8NH3+3N2+2H2,此反应转移12mol电子,然后根据每转移1mol电子吸收30kJ热量,而在M点时生成1.5mol氮气即转移6mol电子来分析计算.
解答 解:N2H4可完全分解为NH3、N2及H2,实验测得分解产物中N2与H2的物质的量的关系如图所示,即分解生成的氮气和氢气的物质的量之比为3:2,故可以得出分解的化学方程式为:7N2H4=8NH3+3N2+2H2,此反应转移12mol电子生成3mol氮气,而在M点时生成1.5mol氮气即转移6mol电子,然后根据每转移1mol电子吸收30kJ热量可知,当转移6mol电子时放出热量Q=30KJ×6=180KJ,
故选B.
点评 本题考查了反应放出的热量的计算,难度中等,根据题目所给的信息写出化学方程式是解题关键.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
15.下列说法中,正确的是( )
| A. | 钠和氢气分别在氯气中燃烧,都产生白色烟雾 | |
| B. | 铜丝在氯气中燃烧,生成蓝色的氯化铜 | |
| C. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分震荡后溶液呈红色 | |
| D. | 氯水中滴入硝酸银溶液会产生白色沉淀 |
12.醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某同学开展了题为“醋酸是弱电解质的实验探究”的探究活动.该同学设计了如下方案,其中错误的是( )
| A. | 先配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 | |
| B. | 取等体积、等pH的CH3COOH溶液和盐酸分别与足量锌反应,若测得反应过程中醋酸产生H2较慢且最终产生H2较多,则醋酸为弱酸 | |
| C. | 先配制一定量0.01 mol/L的CH3COOH和0.10 mol/L的CH3COOH,分别用pH计测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸是弱电解质 | |
| D. | 配制一定量的CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸是弱电解质 |
19.下列物质中属于电解质的是( )
| A. | 硫酸钡 | B. | 氯气 | C. | 铜 | D. | 蔗糖 |
9.下列实验操作正确的是( )
| A. | 蒸馏过程中发现未加沸石,应立即补加沸石 | |
| B. | 分液过程中先将下次液体分出,稍等片刻后再分出上层液体 | |
| C. | 海水提溴即用有机溶剂中海水中萃取溴 | |
| D. | 除去NaCl少量KNO3,可先配成饱和溶液,然后蒸发结晶、趁热过滤 |
5.下列元素中,电负性最大的是( )
| A. | Na | B. | F | C. | O | D. | Cs |
2.下列关于金属元素性质的叙述正确的是( )
| A. | 金属元素的原子只有还原性,离子只有氧化性 | |
| B. | 金属元素在化合物中一定县正化合价 | |
| C. | 金属元素在不同化合物中化合价一定不同 | |
| D. | 金属元素的单质在常温下都是固体 |
3.下列关于铝及其化合物的说法中不正确的是( )
| A. | 铝既可以用于食品包装,也可以用于建筑材料 | |
| B. | 氧化铝既可以用来冶炼铝,也可用作耐火材料 | |
| C. | 氢氧化铝既可以用于治疗胃酸过多,也可用来制备一些铝盐 | |
| D. | 明矾既能用来净水,也可用作消毒剂 |