题目内容
 我国化学家在“铁基(氟掺杂镨氧铁砷化合物)高温超导”材料研究上取得了重要成果,该研究项目荣获2013年度“国家自然科学奖”一等奖.
我国化学家在“铁基(氟掺杂镨氧铁砷化合物)高温超导”材料研究上取得了重要成果,该研究项目荣获2013年度“国家自然科学奖”一等奖.(1)基态Fe2+的核外电子排布式为
(2)氟、氧、砷三种元素中电负性值由大到小的顺序是
(3)Fe(SCN)3溶液中加人NH4F,发生如下反应:Fe(SCN)3+6NH4F═(NH4)3FeF6+3NH4SCN.
①(NH4)3FeF6存在的微粒间作用力除共价键外还有
a.配位键 b.氢键 c.金属键 d.离子键
②已知SCN-中各原子最外层均满足8电子稳定结构,则C原子的杂化方式为
(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,而FeF3晶体熔点高于1000°C,试解释两种化合物熔点差异较大的原因:
(5)氮、磷、砷虽为同主族元素,但其化合物的结构与性质是多样化的.
①该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图1所示,则Y轴可表示的氢化物(RH3)性质可能有
a.稳定性 b.沸点 c.R-H键能 d.分子间作用力
②碳氮化钛化合物在汽车制造和航空航天等领域有广泛的应用,其结构是用碳原子取代氮化钛晶胞(结构如图2)顶点的氮原子,据此分析,这种碳氮化钛化台物的化学式为
考点:晶胞的计算,原子核外电子排布,元素电离能、电负性的含义及应用,化学键,共价键的形成及共价键的主要类型,原子轨道杂化方式及杂化类型判断
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)因为铁为26号元素,亚铁离子的核外有24个电子,根据核外电子排布规律可知基态Fe2+的核外电子排布式为1s22s22p63s23p63d6,据此答题;
(2)根据元素周期律可知,非金属性越强,电负性越大,所以氟、氧、砷三种元素中电负性值由大到小的顺序是F>O>As,据此答题;
(3)①(NH4)3FeF6是离子化学物,铵根离子与六氟合铁酸根之间是离子键,氮与氢之间是共价键,铁与氟之间是配位键,据此答题;
②SCN-中各原子最外层均满足8电子稳定结构,所以可以写出该原子团的结构式为[S=C=N]-,其结构与二氧化碳相似,其中含有2个σ键与2个π键,所以C原子的杂化方式为sp,σ键与π键个数的比为1:1,据此答题;
(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,所以FeCl3是分子晶体,FeF3晶体熔点高于1000°C,所以FeF3是离子晶体,分子晶体中分子之间是范德华力,作用力比较小,而离子键的作用力较大,所以两者的沸点相差较大,据此答题;
(5)①a.N、P、As位于周期表同一主族,从上到下排列,根据元素周期律可知,非金属性越强,氢化物的稳定性越强,因此三种氢化物的稳定性逐渐降低,a正确;b.由于氨气分子间存在氢键,因此氨气的沸点最高,b不正确;c.非金属性越强与氢元素形成的共价键越强,键能越大,因此R-H键能虽原子序数的增大而减小,c正确;d.三种氢化物生成的晶体均是分子晶体,分子间作用力随相对分子质量的增加而增大,d不正确,据此答题;
②根据晶胞结构图利用均摊法可知,在晶胞中含有碳原子数为8×
=1,含有氮原子数为6×
=3,含有钛原子数为12×
+1=4,所以碳、氮、钛原子数之比为1:3:4,据此写出化学式;
(2)根据元素周期律可知,非金属性越强,电负性越大,所以氟、氧、砷三种元素中电负性值由大到小的顺序是F>O>As,据此答题;
(3)①(NH4)3FeF6是离子化学物,铵根离子与六氟合铁酸根之间是离子键,氮与氢之间是共价键,铁与氟之间是配位键,据此答题;
②SCN-中各原子最外层均满足8电子稳定结构,所以可以写出该原子团的结构式为[S=C=N]-,其结构与二氧化碳相似,其中含有2个σ键与2个π键,所以C原子的杂化方式为sp,σ键与π键个数的比为1:1,据此答题;
(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,所以FeCl3是分子晶体,FeF3晶体熔点高于1000°C,所以FeF3是离子晶体,分子晶体中分子之间是范德华力,作用力比较小,而离子键的作用力较大,所以两者的沸点相差较大,据此答题;
(5)①a.N、P、As位于周期表同一主族,从上到下排列,根据元素周期律可知,非金属性越强,氢化物的稳定性越强,因此三种氢化物的稳定性逐渐降低,a正确;b.由于氨气分子间存在氢键,因此氨气的沸点最高,b不正确;c.非金属性越强与氢元素形成的共价键越强,键能越大,因此R-H键能虽原子序数的增大而减小,c正确;d.三种氢化物生成的晶体均是分子晶体,分子间作用力随相对分子质量的增加而增大,d不正确,据此答题;
②根据晶胞结构图利用均摊法可知,在晶胞中含有碳原子数为8×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
解答:
解:(1)因为铁为26号元素,亚铁离子的核外有24个电子,根据核外电子排布规律可知基态Fe2+的核外电子排布式为1s22s22p63s23p63d6,故答案为:1s22s22p63s23p63d6;
(2)根据元素周期律可知,非金属性越强,电负性越大,所以氟、氧、砷三种元素中电负性值由大到小的顺序是F>O>As,故答案为:F>O>As;
(3)①(NH4)3FeF6是离子化学物,铵根离子与六氟合铁酸根之间是离子键,氮与氢之间是共价键,铁与氟之间是配位键,故答案为:ad;
②SCN-中各原子最外层均满足8电子稳定结构,所以可以写出该原子团的结构式为[S=C=N]-,其结构与二氧化碳相似,其中含有2个σ键与2个π键,所以C原子的杂化方式为sp,σ键与π键个数的比为1:1,故答案为:sp,1:1;
(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,所以FeCl3是分子晶体,FeF3晶体熔点高于1000°C,所以FeF3是离子晶体,分子晶体中分子之间是范德华力,作用力比较小,而离子键的作用力较大,所以两者的沸点相差较大,故答案为:FeCl3是分子晶体,FeF3是离子晶体;
(5)①a.N、P、As位于周期表同一主族,从上到下排列,根据元素周期律可知,非金属性越强,氢化物的稳定性越强,因此三种氢化物的稳定性逐渐降低,a正确;b.由于氨气分子间存在氢键,因此氨气的沸点最高,b不正确;c.非金属性越强与氢元素形成的共价键越强,键能越大,因此R-H键能虽原子序数的增大而减小,c正确;d.三种氢化物生成的晶体均是分子晶体,分子间作用力随相对分子质量的增加而增大,d不正确,故答案为:ac;
②根据晶胞结构图利用均摊法可知,在晶胞中含有碳原子数为8×
=1,含有氮原子数为6×
=3,含有钛原子数为12×
+1=4,所以碳、氮、钛原子数之比为1:3:4,据此写出化学式为Ti4CN3,故答案为:Ti4CN3;
(2)根据元素周期律可知,非金属性越强,电负性越大,所以氟、氧、砷三种元素中电负性值由大到小的顺序是F>O>As,故答案为:F>O>As;
(3)①(NH4)3FeF6是离子化学物,铵根离子与六氟合铁酸根之间是离子键,氮与氢之间是共价键,铁与氟之间是配位键,故答案为:ad;
②SCN-中各原子最外层均满足8电子稳定结构,所以可以写出该原子团的结构式为[S=C=N]-,其结构与二氧化碳相似,其中含有2个σ键与2个π键,所以C原子的杂化方式为sp,σ键与π键个数的比为1:1,故答案为:sp,1:1;
(4)FeCl3晶体易溶于水、乙醇,用酒精灯加热即可气化,所以FeCl3是分子晶体,FeF3晶体熔点高于1000°C,所以FeF3是离子晶体,分子晶体中分子之间是范德华力,作用力比较小,而离子键的作用力较大,所以两者的沸点相差较大,故答案为:FeCl3是分子晶体,FeF3是离子晶体;
(5)①a.N、P、As位于周期表同一主族,从上到下排列,根据元素周期律可知,非金属性越强,氢化物的稳定性越强,因此三种氢化物的稳定性逐渐降低,a正确;b.由于氨气分子间存在氢键,因此氨气的沸点最高,b不正确;c.非金属性越强与氢元素形成的共价键越强,键能越大,因此R-H键能虽原子序数的增大而减小,c正确;d.三种氢化物生成的晶体均是分子晶体,分子间作用力随相对分子质量的增加而增大,d不正确,故答案为:ac;
②根据晶胞结构图利用均摊法可知,在晶胞中含有碳原子数为8×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
点评:本题主要考查了核外电子排布、电负性、作用力、共价键、晶体类型与性质及晶胞的计算,综合性较强,有一定的难度.

练习册系列答案
相关题目
下列事实能用勒沙特列原理解释的是( )
①由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
②实验室中用氯化钠固体与浓硫酸共热制取氯化氢气体
③用排饱和食盐水法收集Cl2
④温度控制在500℃有利于合成氨反应
⑤工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来.
①由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
②实验室中用氯化钠固体与浓硫酸共热制取氯化氢气体
③用排饱和食盐水法收集Cl2
④温度控制在500℃有利于合成氨反应
⑤工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来.
| A、②③⑤ | B、①③⑤ |
| C、①②③④⑤ | D、①②③⑤ |
下列说法正确的是( )
A、按系统命名法,化合物 的名称是二溴乙烷 的名称是二溴乙烷 |
| B、丙烯的结构简式为CH2CHCH3 |
| C、2,2-二甲基丙烷的一氯代物有1种 |
| D、苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 |
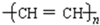 ,这是21世纪具有广阔前景的合成材料.
,这是21世纪具有广阔前景的合成材料.


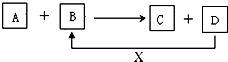 A、B、C、D、X均为中学化学常见的物质.它们之间存在如图所示转化关系(图中反应条件略去)
A、B、C、D、X均为中学化学常见的物质.它们之间存在如图所示转化关系(图中反应条件略去)

 分子式:
分子式: