题目内容
室温下,下列有关两种溶液的说法不正确的是( )
| 序号 | ① | ② |
| pH | 12 | 12 |
| 溶液 | 氨水 | 氢氧化钠溶液 |
| A、①②两溶液中c(OH-)相等 |
| B、①溶液的物质的量浓度为0.01 mol?L-1 |
| C、①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>② |
| D、等体积的①②两溶液分别与0.01 mol?L-1的盐酸完全中和,消耗盐酸的体积:①>② |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A、pH相等的氨水和氢氧化钠溶液中氢氧根离子浓度相等;
B、一水合氨是弱电解质,不能完全电离,氢氧化钠是强电解质,完全电离;
C、pH相等的强碱和弱碱加水稀释,强碱溶液pH变化大;
D、pH相等的氨水和氢氧化钠溶液中,一水合氨的物质的量比氢氧化钠多.
B、一水合氨是弱电解质,不能完全电离,氢氧化钠是强电解质,完全电离;
C、pH相等的强碱和弱碱加水稀释,强碱溶液pH变化大;
D、pH相等的氨水和氢氧化钠溶液中,一水合氨的物质的量比氢氧化钠多.
解答:
解:A、pH相等的氨水和氢氧化钠溶液中氢氧根离子浓度相等,故A正确;
B、一水合氨是弱电解质,不能完全电离,pH=12的氨水中,其物质的量浓度大于0.01mol/L,故B错误;
C、pH相等的氨水和氢氧化钠溶液加水稀释时,NaOH溶液pH变化大,故C正确;
D、pH相等的氨水和氢氧化钠溶液中,一水合氨的物质的量比氢氧化钠多,与盐酸中和时消耗的盐酸①>②,故D正确;
故选B.
B、一水合氨是弱电解质,不能完全电离,pH=12的氨水中,其物质的量浓度大于0.01mol/L,故B错误;
C、pH相等的氨水和氢氧化钠溶液加水稀释时,NaOH溶液pH变化大,故C正确;
D、pH相等的氨水和氢氧化钠溶液中,一水合氨的物质的量比氢氧化钠多,与盐酸中和时消耗的盐酸①>②,故D正确;
故选B.
点评:本题考查pH相等的强碱和弱碱的不同,注意弱电解质存在电离平衡,题目难度不大.

练习册系列答案
相关题目
已知酸性: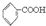 >H2CO3>
>H2CO3> >HCO3-将
>HCO3-将 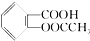 转变为
转变为  ,可行的方法是( )
,可行的方法是( )
 >H2CO3>
>H2CO3> >HCO3-将
>HCO3-将  转变为
转变为  ,可行的方法是( )
,可行的方法是( )| A、向该溶液中加入足量的稀硫酸,加热 |
| B、将该物质与稀硫酸共热后,再加入足量的NaOH溶液 |
| C、将该物质与足量的NaOH溶液共热,再通入足量CO2气体 |
| D、将该物质与稀硫酸共热后,再加入足量的NaHCO3溶液 |
在373K 时,把0.5mol N2O4气体通入体积为5L的密闭容器中发生反应:N2O4(g)?2NO2(g).反应进行到2s时,NO2的浓度为0.02mol?L-1.在60s时,体系已达到平衡,此时容器内压强为反应前的1.6倍.下列说法不正确的是( )
| A、平衡时,化学平衡常数K=1.8 |
| B、平衡时,N2O4的转化率为60% |
| C、前2s,N2O4的平均反应速率为0.005mol?L-1?s-1 |
| D、在2s时,体系内压强为反应前的1.1倍 |
已知I2+SO32-+H2O═SO42-+2I-+2H+.某无色溶液中只可能含有I-,NH4+,Ba2+,SO32-,MnO4-中的一种或几种,若向该溶液中滴加少量的溴水,溶液仍为无色,下列判断正确的是( )
| A、该溶液中肯定不含I- |
| B、该溶液中可能含有Ba2+ |
| C、该溶液中肯定含有NH4+ |
| D、该溶液中可能含有MnO4- |
一定温度下,Wg下列物质在足量氧气中充分燃烧,产物与过量的Na2O2完全反应,Na2O2固体增重Wg,符合此要求的组合是:①H2②CO ③CO和H2 ④HCOOCH3 ⑤HOOC-COOH( )
| A、全部 | B、仅④⑤ |
| C、仅①②③ | D、除⑤外 |
 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图,下列说法正确的是( )| A、滴加过程中当溶液呈中性时,V(NaOH)≥20mL |
| B、当V(NaOH)=30mL时,则有:2c(Na+)=3c(A2-)+3c(HA-) |
| C、H 2A在水中的电离方程式是:H 2A→H++HA-; HA-?H++A2- |
| D、当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
