题目内容
7.链烃A含有5个碳原子且只有一个官能团,1mol A完全燃烧消耗7mol O2,则A烃的类别是炔烃.分析 根据A为烃,且含5个碳原子,设A的分子式为C5Hy,根据1mol A完全燃烧消耗7mol O2,可得5+$\frac{y}{4}$=7,即可解得y.然后根据烃的通式来判断A的类别.
解答 解:由于A为烃,故只含碳、氢两种元素,且含5个碳原子,故可以设A的分子式为C5Hy,
根据1mol A完全燃烧消耗7mol O2,可得5+$\frac{y}{4}$=7,解得y=8
故链烃A为C5H8,符合CnH2n-2,故为炔烃.
故答案为:炔烃.
点评 本题考查了有机物类别的判断,根据所给的信息求出有机物的分子式,根据分子式所符合的通式即可得出有机物的类别,难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
15.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,2.24L CO 和O2 混合气体中含有的碳原子数目为0.1NA | |
| B. | 常温常压下,92g NO2和N2O4的混合气体含有的原子数为6NA | |
| C. | 常温常压下,48g O3含有的分子数为3NA | |
| D. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA |
1.某同学做同周期元素性质递变规律实验时,设计了实验方案,并记录了如下.
请你帮助该同学整理并完成实验报告
(1)实验目的::探究同周期元素的金属性和非金属性的递变规律.
(2)实验内容:(填写与实验方案相对应的实验现象)
①E②A③C④B⑤D
(3)实验结论:同周期元素,从左到右,元素金属性逐渐减弱.
| 实验方案 | 实验现象 |
| ①将镁带用砂纸擦后,放入试管中,加入少量水后,加热至水沸腾;再向反应后溶液中滴加酚酞 | (A)浮于水面,熔成一个小球,四处游动,发出“嘶嘶”声,随之消失,溶液变红色 |
| ②将一小块金属钠放入滴有酚酞试液的冷水反应 | (B)反应不十分剧烈,产生的气体可在空气中燃烧 |
| ③镁带与2mol/L的稀盐酸反应 | (C)剧烈反应,产生的气体可在空气中燃烧 |
| ④铝条与2mol/L的稀盐酸反应 | (D)生成白色胶状沉淀,继而沉淀消失 |
| ⑤向AlCl3溶液滴加NaOH溶液 | (E)产生大量气体,可在空气中燃烧,溶液变红色 |
(1)实验目的::探究同周期元素的金属性和非金属性的递变规律.
(2)实验内容:(填写与实验方案相对应的实验现象)
①E②A③C④B⑤D
(3)实验结论:同周期元素,从左到右,元素金属性逐渐减弱.
2.某研究性小组对Fe3+与S2-的反应有不同的看法,
(1)猜想可能发生三种反应情况:双水解反应;氧化还原反应;复分解反应;(填反应类型).
针对上述猜想该小组做了如下探究实验:
【查阅资料】
Fe2S3是黑色或深黄绿色固体,中性或碱性很稳定,FeS是黑褐色的固体.
(2)根据实验现象和理论分析:实验①发生的离子反应方程式为:2Fe3++3S2-═Fe2S3↓.
实验②发生反应的离子方程式:2Fe3++S2-═2Fe2++S↓.
(3)设计实验验证实验②所发生的化学反应,检验对象是实验②所得混合物.
限选试剂:稀盐酸、NaOH溶液、CS2、KSCN溶液、酸性KMnO4溶液、H2O2.
(4)综合分析实验①、②,影响Fe3+与S2-的反应类型的可能因素有溶液的酸碱性、溶液的滴加顺序;溶液的浓度.(至少填两点)
(1)猜想可能发生三种反应情况:双水解反应;氧化还原反应;复分解反应;(填反应类型).
针对上述猜想该小组做了如下探究实验:
| 序号 | 实验操作 | 现象 |
① | 向大试管中加入20mL 0.1mol?L-1的Na2S溶液 (已知Na2S溶液显碱性,pH约为12),再滴加5mL 0.1mol?L-1的FeCl3溶液,边滴边振荡 | 产生大量黑色沉淀,反应后溶液仍显碱性 |
② | 向另一支大试管中加入20mL 0.1mol?L-1FeCl3溶液(已知FeCl3溶液显酸性,pH约为2),再滴加5mL 0.1mol?L-1的Na2S溶液,边滴边振荡 | 局部有黑色沉淀但瞬间消失,溶液颜色变浅,并产生大量黄色浑浊,反应后溶液仍显酸性 |
Fe2S3是黑色或深黄绿色固体,中性或碱性很稳定,FeS是黑褐色的固体.
(2)根据实验现象和理论分析:实验①发生的离子反应方程式为:2Fe3++3S2-═Fe2S3↓.
实验②发生反应的离子方程式:2Fe3++S2-═2Fe2++S↓.
(3)设计实验验证实验②所发生的化学反应,检验对象是实验②所得混合物.
限选试剂:稀盐酸、NaOH溶液、CS2、KSCN溶液、酸性KMnO4溶液、H2O2.
| 实验操作 | 预期现象和结论 |
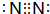 ,物质甲分子的结构式
,物质甲分子的结构式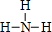 .
. .
. ;
; ,其核磁共振氢谱中有2个吸收峰.
,其核磁共振氢谱中有2个吸收峰. 邻苯二甲酸二异癸酯为无色粘稠液体,密度约为0.966g•cm-3,不溶于水,易溶于有机溶剂,常用作耐热塑料增塑剂.某实验小组的同学用右图所示装置制取少量邻苯二甲酸二异癸酯(图中夹持和加热装置己略去),主要操作步骤如下:
邻苯二甲酸二异癸酯为无色粘稠液体,密度约为0.966g•cm-3,不溶于水,易溶于有机溶剂,常用作耐热塑料增塑剂.某实验小组的同学用右图所示装置制取少量邻苯二甲酸二异癸酯(图中夹持和加热装置己略去),主要操作步骤如下: