题目内容
工业上可用印刷电路板的腐蚀废液生成CuCl2?2H2O,从而对废液进行利用,其工艺流程如图1:
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.
(1)用32%~35%的FeCl3溶液溶解印刷线路板上的金属铜的原理是(用离子方程式表示): .
(2)试剂A最好应选用下列中的 (填字母).理由是 .
a.浓硫酸 b.Cl2 c.NaClO d.NaOH溶液
(3)操作1的名称是 ,用到的玻璃仪器有 .
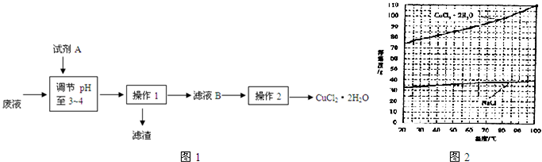
(4)分析有关物质的溶解度曲线(如图2所示),为了获得CuCl2?2H2O晶体,对滤液B进行的操作2是 、 ,过滤得到产品.(5)测定CuCl2?2H2O产品的质量分数可按下列方法进行:取2.000g产品,用水溶解,加入60.00mL 0.4000mol/L的KI溶液(足量),充分反应后加入淀粉指示剂,用0.4000mol/L Na2S2O3标准溶液滴定,耗去标准溶液25.00mL时,刚好达到滴定终点.
已知:2Cu2++4I-=2CuI+I2
I2+2S2O32-=2I-+S4O62-
则此产品中CuCl2?2H2O的质量分数为 .
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.
(1)用32%~35%的FeCl3溶液溶解印刷线路板上的金属铜的原理是(用离子方程式表示):
(2)试剂A最好应选用下列中的
a.浓硫酸 b.Cl2 c.NaClO d.NaOH溶液
(3)操作1的名称是
(4)分析有关物质的溶解度曲线(如图2所示),为了获得CuCl2?2H2O晶体,对滤液B进行的操作2是
已知:2Cu2++4I-=2CuI+I2
I2+2S2O32-=2I-+S4O62-
则此产品中CuCl2?2H2O的质量分数为

考点:金属的回收与环境、资源保护,难溶电解质的溶解平衡及沉淀转化的本质,铁盐和亚铁盐的相互转变,铜金属及其重要化合物的主要性质
专题:几种重要的金属及其化合物
分析:(1)铜具有还原性,铁离子具有氧化性,二者之间发生氧化还原反应;
(2)将废液中的亚铁离子除去,加热蒸发,浓缩结晶即可得到纯净的氯化铜晶体,据此回答.
(3)据物质的分离方法确定;
(4)为了获得CuCl2?2H2O晶体,需要利用重结晶法把硫酸钠除掉,蒸发浓缩后,由于同温下硫酸钠的溶解度小,会有大量硫酸钠析出,故趁热过滤掉析出的硫酸钠;而40摄氏度时硫酸钠溶解度最大,硫酸钠最不容易析出,为了得到更多的析出CuCl2?2H2O晶体,温度略低于40℃的范围内分离;根据反应的过程:2Cu2++4I-=2CuI↓+I2,I2+2S2O32-=2I-+S4O62-,得到关系式:Cu2+~S2O32-,进行计算即可.
(2)将废液中的亚铁离子除去,加热蒸发,浓缩结晶即可得到纯净的氯化铜晶体,据此回答.
(3)据物质的分离方法确定;
(4)为了获得CuCl2?2H2O晶体,需要利用重结晶法把硫酸钠除掉,蒸发浓缩后,由于同温下硫酸钠的溶解度小,会有大量硫酸钠析出,故趁热过滤掉析出的硫酸钠;而40摄氏度时硫酸钠溶解度最大,硫酸钠最不容易析出,为了得到更多的析出CuCl2?2H2O晶体,温度略低于40℃的范围内分离;根据反应的过程:2Cu2++4I-=2CuI↓+I2,I2+2S2O32-=2I-+S4O62-,得到关系式:Cu2+~S2O32-,进行计算即可.
解答:
解:(1)铜具有还原性,铁离子具有氧化性,二者之间发生的氧化还原反应为:2FeCl3+Cu=2FeCl2+CuCl2,离子方程式为:2Fe3++Cu=2Fe2++Cu2+;故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)为了将废液中的亚铁离子除去,加入一种试剂将亚铁离子氧化为铁离子,调节pH值,可以将铁离子沉淀出来,但是铜离子不沉淀即可,故选NaClO,它具有碱性和氧化性,能将Fe2+氧化为Fe3+,且反应能消耗H+,增大溶液的pH使Fe3+沉淀,
故答案为:c;NaClO能将Fe2+氧化为Fe3+,且反应能消耗H+,增大溶液的pH使Fe3+沉淀;
(3)据物质的分离方法,溶液与不溶的分离,采用过滤;据过滤确定所需要的玻璃仪器仪器:漏斗、烧杯、玻璃棒;
答案为:过滤;漏斗、烧杯、玻璃棒;
(4))有图2可知硫酸钠的溶解度较小而且温度较高时随温度的变化不大,加热浓缩时会有大量的硫酸钠析出,冷却结晶时尽量保证硫酸钠不析出,而40摄氏度时硫酸钠溶解度最大,为了能析出更多的CuCl2?2H2O晶体,
依据2Na2S2O3+I2═Na2S4O6+2NaI,2Cu2++4I-=2CuI↓+I2;
得到 Na2S2O3 ~Cu2+
1 1
0.4000mol/L×0.0250L 0.01mol
则CuCl2?2H2O的物质的量为:0.01mol,
试样中CuCl2?2H2O的质量百分数为
×100%=85.50%,
故答案为:蒸发浓缩、冷却结晶;85.50%;
(2)为了将废液中的亚铁离子除去,加入一种试剂将亚铁离子氧化为铁离子,调节pH值,可以将铁离子沉淀出来,但是铜离子不沉淀即可,故选NaClO,它具有碱性和氧化性,能将Fe2+氧化为Fe3+,且反应能消耗H+,增大溶液的pH使Fe3+沉淀,
故答案为:c;NaClO能将Fe2+氧化为Fe3+,且反应能消耗H+,增大溶液的pH使Fe3+沉淀;
(3)据物质的分离方法,溶液与不溶的分离,采用过滤;据过滤确定所需要的玻璃仪器仪器:漏斗、烧杯、玻璃棒;
答案为:过滤;漏斗、烧杯、玻璃棒;
(4))有图2可知硫酸钠的溶解度较小而且温度较高时随温度的变化不大,加热浓缩时会有大量的硫酸钠析出,冷却结晶时尽量保证硫酸钠不析出,而40摄氏度时硫酸钠溶解度最大,为了能析出更多的CuCl2?2H2O晶体,
依据2Na2S2O3+I2═Na2S4O6+2NaI,2Cu2++4I-=2CuI↓+I2;
得到 Na2S2O3 ~Cu2+
1 1
0.4000mol/L×0.0250L 0.01mol
则CuCl2?2H2O的物质的量为:0.01mol,
试样中CuCl2?2H2O的质量百分数为
| 0.01mol×171g/mol |
| 2.0g |
故答案为:蒸发浓缩、冷却结晶;85.50%;
点评:本题以实验的方法考查学生含铁化合物的性质知识,注重物质的分离、提纯和化学实验基本操作的知识以及根据化学方程式进行计算的知识,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
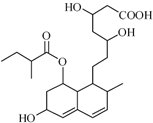 普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )| A、能与FeCl3 溶液发生显色反应 |
| B、不能使酸性KMnO4 溶液褪色 |
| C、能发生加成、取代、消去反应 |
| D、1 mol 该物质最多可与1 mol NaOH 反应 |
制造水泥和玻璃都需用到的原料是( )
| A、粘土 | B、石英 | C、石灰石 | D、纯碱 |
对下列化学反应的热现象,不正确的说法是( )
| A、有些放热反应发生时需要加热 |
| B、化学反应一定既有物质变化又有能量变化 |
| C、吸热反应都需要加热后才能发生 |
| D、化学反应热效应数值与反应物质多少有关 |
有X、Y两种元素,它们的原子序数都小于18,它们的离子属于下列哪种情况,则X、Y必属于同一周期的元素( )
| A、X、Y的离子具有相同的电子层结构 |
| B、X-比Y2-少一个电子层 |
| C、X+ 和Y2-具有相同的电子层结构 |
| D、X+比Y2-少一个电子层 |
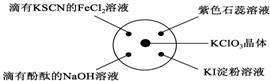 已知:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O.如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.下表中由实验现象得出的结论完全正确的是( )
已知:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O.如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.下表中由实验现象得出的结论完全正确的是( )