题目内容
立足教材实验是掌握高中化学实验的基础,是理解化学科学的实验原理、实验方法和实验思路,提高学生实验能力的基本途径.
(1)实验1:在两支试管里分别加入5mL 盐酸和5mL NaOH溶液,在各放入一小段铝片,观察实验现象.试写出铝和NaOH溶液反应的离子方程式: ;
(2)实验2:在玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气.该氧化还原反应的氧化剂是 ;其化学反应方程式为: .
(3)实验3:在试管里注入少量新制备的FeSO4溶液,用胶头滴管吸取NaOH溶液,将滴管尖端插入试管里溶液底部,慢慢挤出NaOH溶液,可以看到开始时析出一种白色的絮状沉淀,并迅速变成灰绿色,最后变成红褐色.发生这种颜色变化的原因是(用化学方程式表示): .
(1)实验1:在两支试管里分别加入5mL 盐酸和5mL NaOH溶液,在各放入一小段铝片,观察实验现象.试写出铝和NaOH溶液反应的离子方程式:
(2)实验2:在玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气.该氧化还原反应的氧化剂是
(3)实验3:在试管里注入少量新制备的FeSO4溶液,用胶头滴管吸取NaOH溶液,将滴管尖端插入试管里溶液底部,慢慢挤出NaOH溶液,可以看到开始时析出一种白色的絮状沉淀,并迅速变成灰绿色,最后变成红褐色.发生这种颜色变化的原因是(用化学方程式表示):
考点:铝的化学性质,铁的化学性质,铁的氧化物和氢氧化物
专题:元素及其化合物
分析:(1)反应生成偏铝酸钠和氢气;
(2)Fe与水蒸气反应生成四氧化三铁和氢气,Fe元素的化合价升高,H元素的化合价降低;
(3)白色的絮状沉淀,并迅速变成灰绿色,最后变成红褐色,氢氧化亚铁被氧化生成氢氧化铁.
(2)Fe与水蒸气反应生成四氧化三铁和氢气,Fe元素的化合价升高,H元素的化合价降低;
(3)白色的絮状沉淀,并迅速变成灰绿色,最后变成红褐色,氢氧化亚铁被氧化生成氢氧化铁.
解答:
解:(1)反应生成偏铝酸钠和氢气,离子反应为2Al+2H2O+2OH-═2AlO2-+3H2↑,故答案为:2Al+2H2O+2OH-═2AlO2-+3H2↑;
(2)Fe与水蒸气反应生成四氧化三铁和氢气,反应为3Fe+4H2O
Fe3O4+4H2,Fe元素的化合价升高,H元素的化合价降低,则H2O为氧化剂,
故答案为:H2O;3Fe+4H2O
Fe3O4+4H2;
(3)白色的絮状沉淀,并迅速变成灰绿色,最后变成红褐色,氢氧化亚铁被氧化生成氢氧化铁,反应为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(2)Fe与水蒸气反应生成四氧化三铁和氢气,反应为3Fe+4H2O
| ||
故答案为:H2O;3Fe+4H2O
| ||
(3)白色的絮状沉淀,并迅速变成灰绿色,最后变成红褐色,氢氧化亚铁被氧化生成氢氧化铁,反应为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评:本题考查Al、Fe的化学性质,为高频考点,把握物质的性质及发生的反应为解答的关键,侧重化学反应及现象的考查,注意现象与反应的对应关系,题目难度不大.

练习册系列答案
相关题目
固体硝酸盐加热易分解且产物较复杂.某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想,其中不成立的是( )
| A、Mg(NO3)2、NO2、O2 |
| B、MgO、NO2、O2 |
| C、Mg3N2、O2 |
| D、MgO、NO2、N2 |
醋酸溶液中存在电离平衡CH3COOH?H++CH3COO-,下列叙述不正确的是( )
| A、醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) |
| B、0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 |
| C、CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 |
| D、常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
将1.12克铁粉加入25ml 2mol/L的FeCl3溶液中,充分反应后,下列说法正确的是( )
| A、铁有剩余,溶液呈浅绿色,Cl-离子的浓度基本不变 |
| B、往溶液中滴加无色的KSCN溶液,溶液颜色不变 |
| C、Fe2+和Fe3+ 的物质的量之比为6:1 |
| D、氧化产物和还原产物的物质的量之比为2:5 |
随着高科技的发展,新型产品不断涌现,在2010年全国两会初次亮相的用碳酸钙制取的“石头纸”就是其中之一.下列关于“石头纸”的叙述中正确的是( )
①它不溶于水、可反复使用;
②原材料为矿物质,密度大于普通纸;
③该产品原料为植物纤维,密度比普通纸小;
④生产工艺不使用强酸、强碱;
⑤该产品韧性大、防潮、可降解,是良好的环保产品.
①它不溶于水、可反复使用;
②原材料为矿物质,密度大于普通纸;
③该产品原料为植物纤维,密度比普通纸小;
④生产工艺不使用强酸、强碱;
⑤该产品韧性大、防潮、可降解,是良好的环保产品.
| A、①②③④⑤ | B、①②④⑤ |
| C、③④⑤ | D、①③④⑤ |
下列说法不正确的是( )
| A、CaCl2在熔融状态下可导电,它是强电解质 |
| B、自来水可用氯气来杀菌消毒,说明氯气无毒 |
| C、碱性氧化物一定是金属氧化物 |
| D、减少化石燃料的燃烧,是缓解大气“温室效应”的有效措施 |
下列反应中,属于氧化还原反应的是( )
| A、2NaHCO3═Na2CO3+H2O+CO2↑ |
| B、KClO3+6HCl(浓)=KCl+3H2O+3Cl2↑ |
| C、CO2+Ca(OH) 2=CaCO3↓+H2O |
| D、FeS+H2SO4=FeSO4+H2S↑ |
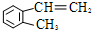 )是一种重要的有机化工原料.
)是一种重要的有机化工原料.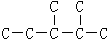 ,此烷烃的一溴代物有
,此烷烃的一溴代物有