题目内容
1.用NA表示阿伏加德罗常数,下列叙述正确的是( )| A. | 标准状况下,22.4L H2O含有的分子数为1NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA | |
| C. | 常温常压下,22.4L CO2气体含有原子数为3NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA |
分析 A、标况下水为液态;
B、求出碳酸钠的物质的量,然后根据1mol碳酸钠中含2mol钠离子来分析;
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、溶液体积不明确.
解答 解:A、标况下水为液态,故不能根据气体摩尔体积来计算其物质的量和含有的分子数,故A错误;
B、1.06g碳酸钠的物质的量为0.01mol,而1mol碳酸钠中含2mol钠离子,故0.01mol碳酸钠中含0.02NA个钠离子,故B正确;
C、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L二氧化碳的物质的量小于1mol,故含有的原子个数小于3NA个,故C错误;
D、溶液体积不明确,故溶液中的氯离子的个数无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
11.以下物质:①甲烷;②苯;③聚乙烯;④1,3-丁二烯;⑤2-丁炔;⑥环己烷;⑦邻二甲苯,既能使酸性高锰酸钾溶液褪色又能与溴水因发生化学反应使之褪色的是( )
| A. | ③④⑤ | B. | ④⑤⑦ | C. | ④⑤ | D. | ③④⑤⑦ |
12.下列有机物发生的反应属于加成反应的是( )
| A. | 乙烯通入KMnO4溶液中 | B. | 乙烯通入溴水中 | ||
| C. | 甲烷和氯气混合光照 | D. | 苯与浓硫酸、浓硝酸混合加热 |
9.下列有关金属元素的说法正确的是( )
| A. | 金属在常温下都是固态 | B. | 金属具有导电性、导热性和延展性 | ||
| C. | 金属都能与稀盐酸反应放出氢气 | D. | 金属在自然界中都是以化合态存在 |
6.下列离子方程式中书写错误的是( )
| A. | AgNO3溶液跟NaCl溶液反应:Ag++Cl-═AgCl↓ | |
| B. | Cl2跟KI溶液反应:Cl2+2I-═I 2+2Cl- | |
| C. | H2SO4跟Ba(OH)2溶液反应H++OH-═H2O | |
| D. | Fe跟FeCl3溶液反应:Fe+2Fe3+═3Fe2+ |
13.已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构.下列关于X、Y、Z、W四种元素的描述,不正确的是( )
| A. | 原子序数:Y>X>Z>W | B. | 离子半径:X+>Y2+>Z->W2- | ||
| C. | 原子最外层电子数:Z>W>Y>X | D. | 原子半径:X>Y>W>Z |
10.溶液X中只可能含有以下离子中的若干种(不考虑盐类的水解及水的电离):K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取100mL溶液X进行如下实验(部分产物省略):
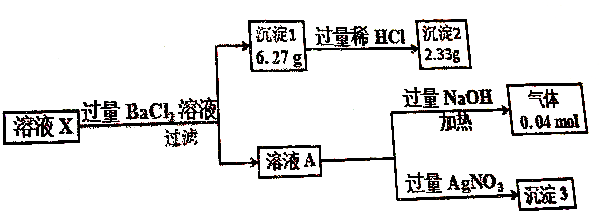
下列说法正确的是( )

下列说法正确的是( )
| A. | 溶液X中存在大量Mg2+ | |
| B. | 溶液X中一定存在K+ | |
| C. | 溶液X中c(CO32-)=0.02mol•L-1 | |
| D. | 溶液X中一定存在NH4+、Cl-、CO32-、SO42- |