题目内容
前四周期元素X、Y、Z、W、Q的原子序数依次增大.X与Y同周期相邻的非金属元素,Y的基态原子s电子数与p电子数相等,Z是地壳中含量最多的金属元素,W的价电子排布为4s1,基态Q原子的未成对电子是同周期元素中最多的.下列说法错误的是( )
| A、简单氢化物的热稳定性:Y>X |
| B、简单离子的半径:Z>X>Y |
| C、Z的最高价氧化物对应水化物既能与强酸反应又能与强碱反应生产盐和水 |
| D、由Y、W、Q三种元素形成的某种化合物,可用于检查司机酒后驾车 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:前四周期元素X、Y、Z、W、Q的原子序数依次增大.Z是地壳中含量最多的金属元素,则Z为Al;Y原子序数小于Al,Y的基态原子s电子数与p电子数相等,核外电子排布为1s22s22p4或1s22s22p63s2,X与Y同周期相邻的非金属元素,则Y为O,X为N元素;W的价电子排布为4s1,则W为K;结合原子序数可知,Q处于第四周期,基态Q原子的未成对电子是同周期元素中最多的,原子外围电子排布为3d54s1,则Q为Cr,结合元素周期律解元素化合物性质解答.
解答:
解:前四周期元素X、Y、Z、W、Q的原子序数依次增大.Z是地壳中含量最多的金属元素,则Z为Al;Y原子序数小于Al,Y的基态原子s电子数与p电子数相等,核外电子排布为1s22s22p4或1s22s22p63s2,X与Y同周期相邻的非金属元素,则Y为O,X为N元素;W的价电子排布为4s1,则W为K;结合原子序数可知,Q处于第四周期,基态Q原子的未成对电子是同周期元素中最多的,原子外围电子排布为3d54s1,则Q为Cr,
A.非金属性O>N,故简单氢化物稳定性:O>N,故A正确;
B.电子层结构相同,核电荷数越大离子半径越小,故离子半径N3->O2->Al3-,故B错误;
C.氢氧化铝是两性氢氧化物,与强酸反应生成铝盐与水,与强碱反应都生成偏铝酸盐与水,故C正确;
D.由O、K、Cr形成的化合物K2Cr2O7,可用于检查司机酒后驾车,故D正确,
故选B.
A.非金属性O>N,故简单氢化物稳定性:O>N,故A正确;
B.电子层结构相同,核电荷数越大离子半径越小,故离子半径N3->O2->Al3-,故B错误;
C.氢氧化铝是两性氢氧化物,与强酸反应生成铝盐与水,与强碱反应都生成偏铝酸盐与水,故C正确;
D.由O、K、Cr形成的化合物K2Cr2O7,可用于检查司机酒后驾车,故D正确,
故选B.
点评:本题考查结构性质位置关系应用,难度不大,推断元素是解题关键,注意对基础知识全面掌握.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
下列各组离子可以在溶液中大量共存的是( )
| A、K+、Fe2+、SO42-、OH- |
| B、Na+、H+、Cl-、HCO3- |
| C、K+、Ag+、NO3-、Cl- |
| D、K+、Cu2+、SO42-、NO3- |
根据下面的信息,判断下列叙述中正确的是( )

| A、氢气跟氧气反应生成水的同时释放能量 | ||
| B、氢气跟氧气反应生成水的同时吸收能量 | ||
C、1mol H2跟
| ||
| D、2mol H2(g)跟1mol O2(g)反应生成2mol H2O(g)释放能量490kJ |
下列物质互为同分异构体的一组是( )
| A、12C和14C |
| B、NO和NO2 |
C、CH3CH2CH2CH3和 |
| D、CH3COOH和CH3OCH3 |
下列说法正确的是( )
| A、用新制氢氧化铜悬浊液可检验失去标签的乙醇、丙三醇、乙醛、乙酸四瓶无色溶液 |
| B、检验氯乙烷中的氯元素时,可先将氯乙烷硝酸进行酸化,再加硝酸银溶液来检验,通过观察是否有白色沉淀来判断是否存在氯元素 |
| C、摩尔盐制备过程中铁屑要先用碳酸钠溶液浸泡洗涤,使用热的碳酸钠溶液有利提高去油污的能力,最后分离溶液和固体时不可以用倾析法 |
| D、由于苯酚与溴水发生反应时,副反应多,所以只能利用溴水对含苯酚的废水作定性检验,不能用作定量测定 |
下列关于有机化合物的叙述中正确的是( )
| A、糖类、蛋白质是高分子化合物,适当的条件下可以发生水解反应 |
| B、甲烷和氯气光照条件下发生取代反应,产物是气体与液体混合物 |
| C、纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 |
| D、乙醇与乙酸不能混合,因为二者可以马上生成乙酸乙酯 |
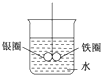 如图所示的装置,在铁圈和银圈的焊接处,用一根棉线将其悬吊在盛水的烧杯中,使之平衡.小心地向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )
如图所示的装置,在铁圈和银圈的焊接处,用一根棉线将其悬吊在盛水的烧杯中,使之平衡.小心地向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )| A、铁圈和银圈左右摇摆不定 |
| B、保持平衡状况 |
| C、银圈向下倾斜 |
| D、铁圈向下倾斜 |
