题目内容
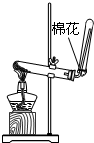
11.下列实验装置及操作不能达到实验目的是( )| A.用Ca(OH)2和 NH4Cl制取NH3 | B.从碘水中提取碘单质 | C.从食盐水中获取氯化钠 | D.用自来水制取蒸馏水 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
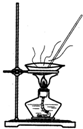
分析 A.Ca(OH)2和NH4Cl在加热条件下可生成NH3,氨气密度比空气小;
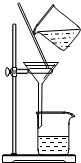
B.碘易溶于有机溶剂;
C.可用蒸发的方法分离氯化钠;
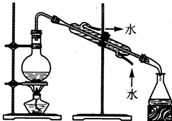
D.水易挥发,可用蒸馏的方法制备蒸馏水.
解答 解:A.Ca(OH)2和NH4Cl在加热条件下可生成NH3,氨气密度比空气小,反应生成水,试管口略向下倾斜,故A正确;
B.碘易溶于有机溶剂,应用萃取的方法分离,故B错误;
C.水易挥发,可用蒸发的方法分离氯化钠,故C正确;
D.水易挥发,可用蒸馏的方法制备蒸馏水,故D正确.
故选B.
点评 本题考查较为综合,涉及物质的分离、制备等基本实验操作的考查,侧重于实验方案的评价,注意把握物质的性质以及操作要点,题目难度不大.

练习册系列答案
相关题目
6.对于铁与盐酸生成氢气的反应,下列条件下反应速率最快的是( )
| 选项 | 铁的状态 | 盐酸的浓度 | 反应的温度 |
| A | 片状 | 1 mol/L | 20℃ |
| B | 片状 | 3 mol/L | 40℃ |
| C | 粉末 | 1 mol/L | 20℃ |
| D | 粉末 | 3 mol/L | 40℃ |
| A. | A | B. | B | C. | C | D. | D |