题目内容
20.回答下列问题:I、①~⑨是几种有机物的名称或化学式:
①2,2,3-三甲基丁烷 ②3-甲基-1-氯戊烷 ③甲苯 ④
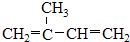 ⑤ClCH=CHCl ⑥
⑤ClCH=CHCl ⑥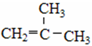 ⑦
⑦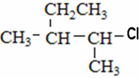 ⑧
⑧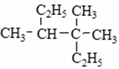 ⑨
⑨
据此回答下列问题:
(1)用系统命名法命名有机物⑧:3,3,4-三甲基己烷.
(2)上述有机物中,互为同分异构体的是②和⑦(用编号表示),互为同系物的是①和⑧、③和⑨(用编号表示),存在顺反异构的是⑤(用编号表示).
(3)③苯环上的四氯代物有3种,以该有机物为原料制备TNT炸药的化学方程式为
 .
.II、某有机高分子化合物的结构片段如图,则合成它的单体是CH2=CH2、CH2=CHCN、CH≡CH.
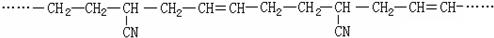
分析 I、(1)⑧为烷烃,根据烷烃的命名原则对该有机物进行命名,选取最长的链为主链;
(2)同系物是结构相似,在组成上相差CH2原子团的物质互称同系物;同分异构体是分子式相同结构不同的物质;根据具有顺反异构体的有机物中C=C应连接不同的原子或原子团;
(3)甲苯苯环上的一氯取代物可以看作甲苯中1个氢原子被1个氯原子取代,甲苯苯环上有5个氢原子,环上的四氯代物可以看作苯环五氯代物其中1个氯原子被1个氢原子取代,故一氯代物与四氯代物同分异构体数目相同;甲苯在浓硫酸作用下可与浓硝酸反应生成TNT;
II、凡链节主链上只有碳原子并存在碳碳双键结构的高聚物,其规律是“见双键,四个碳,无双键,两个碳”画线断开,然后将半键闭合,即将单双键互换,即可得到单体.
解答 解:(1)⑧ 为烷烃,最长碳链含有6个碳,其主链为己烷,在3号C含有2个甲基,在4号C含有1个甲基,其名称为:3,3,4-三甲基己烷;
为烷烃,最长碳链含有6个碳,其主链为己烷,在3号C含有2个甲基,在4号C含有1个甲基,其名称为:3,3,4-三甲基己烷;
故答案为:3,3,4-三甲基己烷;
(2)②3-甲基-1-氯戊烷与⑦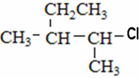 分子式相同,结构不同,属于同分异构体;
分子式相同,结构不同,属于同分异构体;
①与⑧均为饱和烷烃,结构相似、分子式不同,故属于同系物,③和⑨均含有1个苯环,且分子式不同,互为苯的同系物;
⑤ClCH=CHCl为1,2-二氯乙烯,碳碳双键上的C连接不同原子或原子团,存在顺反异构;
故答案为:②和⑦;①和⑧、③和⑨;⑤;
(3)甲苯有3种不同的H原子,故一氯代物有3种,分别为邻位取代,间位取代和对位取代,甲苯苯环上有5个氢原子,一氯代物与四氯代物同分异构体数目相同,所以苯环上的四氯代物有3种;在浓硫酸作用下可与浓硝酸反应生成TNT,反应的化学方程式为 ;
;
故答案为:3; ;
;
II、根据“凡链节主链上只有碳原子并存在碳碳双键结构的高聚物,其规律是“见双键,四个碳,无双键,两个碳”画线断开,然后将半键闭合,即可得到单体”知,该高分子有机物的单体是:CH2=CH2、CH2=CHCN、CH≡CH;
故答案为:CH2=CH2;CH2=CHCN;CH≡CH.
点评 主要考查了烃、同系物、同分异构体概念的理解,有机物的结构片段判断单体等,难点是根据有机物的结构片段判断单体.

| A. | CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890 kJ/mol | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890kJ/mol | |
| C. | CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-445kJ/mol | |
| D. | CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol |
①OH-的电子式
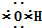
②乙烯的结构简式:CH2=CH2
③甲烷的结构式
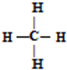
④乙烯的结构式:C2H4.
| A. | ①④ | B. | ②④ | C. | ②③ | D. | ①② |
| A. | 苯和环己烷 | B. | 硝基苯和溴苯 | C. | 乙酸乙酯和乙醇 | D. | 乙醇和乙酸 |
Ⅰ.制备TiCl4
实验室利用反应TiO2 (s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(1)仪器A的名称是球形干燥管.
(2)实验开始前的操作包括:①组装仪器,②检验装置气密性,③加装药品,④通N2一段时间,⑤最后点燃酒精灯.实验结束后欲分离D中的液态混合物,所采用操作的名称是蒸馏 (或分馏).
(3)装置E能否不能(填“能”或“不能”)换成装置A,理由是装置A不能吸收空气中的氧气,不能保证反应在无氧环境下进行
(4)TiCl4是制取航天航空工业材料--钛合金的重要原料.某钛合金的元素还有Al和Si等,已知在常温下,钛是一种耐强酸强碱的金属,请设计实验检验其中的Si元素取少量合金样品于试管中,滴加过量NaOH溶液,振荡,静置后取上层清液,再逐滴滴入稀盐酸至过量,若有沉淀产生且最终沉淀不完全溶解,则证明样品中有Si
Ⅱ.制备TiO2及测定TiO2的质量分数:
在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.
(5)写出生成TiO2•xH2O的化学方程式TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl.
(6)一定条件下,将TiO2溶解并还原为Ti3+,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.滴定分析时,称取上述TiO2试样0.2g,消耗0.1mol•L-1 NH4Fe(SO4)2标准溶液20mL.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
②该滴定操作所用到的指示剂是KSCN溶液.
③则TiO2质量分数为80%.
| A. | 苯酚溶液 | B. | 乙醇溶液 | C. | 福尔马林 | D. | 乙酸乙酯溶液 |
实 验 报 告
(一)实验目的:探究钠及其化合物的有关性质
(二)实验药品及仪器:金属钠,蒸馏水,酒精灯,试管,木条,石棉网,铁架台
(三)实验过程:
| 实验步骤 | 实验现象 | 化学方程式或结论 |
| 金属Na长时间放置在空气中 | 银白色的金属光泽消失,迅速变暗,有水珠生成,最终生成白色的粉末 | ①4Na+O2═2Na2O Na2O+H2O═2NaOH 2Na+2H2O═2NaOH+H2↑ 2NaOH+CO2═Na2CO3+H2O |
| 将一块Na置于石棉网上,点燃酒精灯加热 | 钠先熔成小球,剧烈燃烧并发出黄色的火焰,生成②淡黄色色的粉末 | 2Na+O2 ═Na2O2 |
| 往上述生成的 Na2O2上滴加蒸馏水 | 生成的气体能使带火星的木条复燃 | 该气体为③O2 |
(1)钠的化学性质活泼,在自然界中全部以化合态形态(填“游离态”或“化合态”)存在,因此少量钠应保存在煤油中.
(2)写出Na2O2的一种用途:作供氧剂或利用强氧化性杀菌消毒.
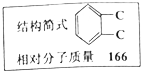 实验室有一试剂瓶的标签严重破损,只能隐约看到如图所示部分,取该试剂瓶中的试剂,通过燃烧实验测得:0.1mol该物质完全燃烧只得到39.6gCO2和9gH2O.
实验室有一试剂瓶的标签严重破损,只能隐约看到如图所示部分,取该试剂瓶中的试剂,通过燃烧实验测得:0.1mol该物质完全燃烧只得到39.6gCO2和9gH2O.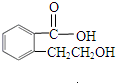 ;
; .
.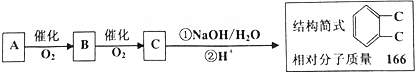
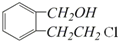 ;
;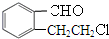 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2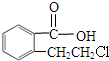 ;
; .
.