题目内容
11.下列属于复分解反应的是( )| A. | 2KBr+Cl2=2KCl+Br2 | B. | CaCO3=CaO+CO2↑ | ||
| C. | SO3+H2O=H2SO4 | D. | MgCl2+2NaOH=Mg(OH)2↓+2NaCl |
分析 化合物与化合物反应生成两种新化合物的反应为复分解反应,以此来解答.
解答 解:A.为单质、化合物反应生成新单质、化合物的反应,属于置换反应,故A不选;
B.为一种物质分解生成两种物质的反应,属于分解反应,故B不选;
C.为两种物质化合生成一种物质的反应,属于化合反应,故C不选;
D.为化合物与化合物反应生成两种新化合物的反应,属于复分解反应,故D选;
故选D.
点评 本题考查基本反应类型,为高频考点,把握物质的类别、种类、反应分类为解答的关键,侧重分析与应用能力的考查,注意四种基本反应类型的判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.CoO是电子陶瓷所需的重要原料,工业上可用含有Co2O3、Fe2O3、Li和Al等物质的废料制备CoO.生产流程如图:

已知:①Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
(1)为提高碱溶速率,除适当增大NaOH溶液浓度、提高反应温度外,还可采取的措施有将废料研磨成更小颗粒.
(2)步骤Ⅱ中酸溶时发生了反应:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O,此反应的目的是溶解Co2O3,将三价钴转化为Co2+,便于沉淀除去Fe3+.
(3)步骤Ⅲ中加入Na2CO3溶液的作用是调节溶液的pH,物质X的化学式为Fe(OH)3.
(4)步骤Ⅲ中加入NaF对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅵ中产生Li2CO3沉淀.
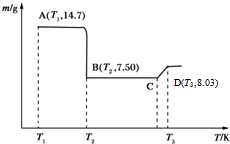
(5)操作A的步骤为过滤、洗涤、干燥,将所得的草酸钴晶体高温灼烧,其热重分析图如图:写出B点物质的化学式:CoO,CD段发生反应的化学方程式为:6CoO+O2=2Co3O4.

已知:①Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(2)步骤Ⅱ中酸溶时发生了反应:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O,此反应的目的是溶解Co2O3,将三价钴转化为Co2+,便于沉淀除去Fe3+.
(3)步骤Ⅲ中加入Na2CO3溶液的作用是调节溶液的pH,物质X的化学式为Fe(OH)3.
(4)步骤Ⅲ中加入NaF对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅵ中产生Li2CO3沉淀.
(5)操作A的步骤为过滤、洗涤、干燥,将所得的草酸钴晶体高温灼烧,其热重分析图如图:写出B点物质的化学式:CoO,CD段发生反应的化学方程式为:6CoO+O2=2Co3O4.

2.如图所示原电池装置中,电解质溶液为稀盐酸,下列有关叙述错误的是( )


| A. | 锌做正极发生还原反应 | |
| B. | 供电时的总反应为:Zn+2H+=Zn2++H2 | |
| C. | 该装置可实现化学能转化为电能 | |
| D. | 产生1molH2,消耗锌的质量65g |
19.常温下可盛放在铁制或铝制容器中的是( )
| A. | 稀硫酸 | B. | 浓硫酸 | C. | 亚硫酸 | D. | 硫酸铜溶液 |
16.下列说法不正确的是( )
| A. | 126C和146C互为同位素 | |
| B. | 红磷和白磷互为同素异形体 | |
| C. | 乙酸乙酯的结构简式为CH3CH2COOCH3 | |
| D. | CH3CH2OH可看成是由-C2H5和-OH两种基团组成 |
1.在给定的条件下,下列选项所示的物质间转化均能实现的是( )
| A. | N2$\stackrel{O_{2}}{→}$NO2$?_{Cu}^{H_{2}O}$HNO3 | |
| B. | Fe$\stackrel{HCl}{→}$FeCl2$?_{Fe}^{HCl}$FeCl3 | |
| C. | C$→_{点燃}^{O_{2}}$CO$?_{C,高温}^{O_{2},点燃}$CO2 | |
| D. | AgNO3(aq)$\stackrel{NH_{3}•H_{2}O}{→}$[Ag(NH3)2]OH(aq)$→_{△}^{蔗糖}$Ag |


 .
. .
. .
. .
.