题目内容
列有关物质用途的说法中,正确的是( )
| A、硅可用作绝缘材料 |
| B、液氨可用作制冷剂 |
| C、氯化钠常用于中和胃酸 |
| D、铝制容器常用于盛装稀硫酸 |
考点:硅和二氧化硅,氨的物理性质,铝的化学性质
专题:
分析:A.Si属于半导体材料;
B.液氨蒸发吸收热量,导致其周围温度降低;
C.能中和胃酸的物质具有碱性;
D.铝和稀硫酸反应生成可溶性的硫酸铝.
B.液氨蒸发吸收热量,导致其周围温度降低;
C.能中和胃酸的物质具有碱性;
D.铝和稀硫酸反应生成可溶性的硫酸铝.
解答:
解:A.Si处于金属和非金属非极性处,具有金属和非金属的性质,所以Si单质是良好的半导体材料,故A错误;
B.液氨蒸发吸收热量,导致其周围温度降低,所以液氨可以作制冷剂,故B正确;
C.能中和胃酸是物质具有碱性,NaCl属于强酸弱碱盐,属于中性物质,常用于中和胃酸的物质有碳酸氢钠、氢氧化铝等,故C错误;
D.Al能和酸、碱反应生成可溶性盐,所以Al不能盛放酸性或碱性物质,故D错误;
故选B.
B.液氨蒸发吸收热量,导致其周围温度降低,所以液氨可以作制冷剂,故B正确;
C.能中和胃酸是物质具有碱性,NaCl属于强酸弱碱盐,属于中性物质,常用于中和胃酸的物质有碳酸氢钠、氢氧化铝等,故C错误;
D.Al能和酸、碱反应生成可溶性盐,所以Al不能盛放酸性或碱性物质,故D错误;
故选B.
点评:本题考查元素化合物知识,属于考查热点,涉及Al、N、Si元素,明确物质的性质是解本题关键,根据物质的性质确定其用途,题目难度不大.

练习册系列答案
相关题目
下列有关物质性质的比较顺序中,不正确的是( )
| A、热稳定性:HF>HCl>HBr>HI |
| B、微粒半径:K+>Na+>Mg2+>Al3+ |
| C、酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
| D、沸点:HF>HCl>HBr>HI |
常温下,能用铁制容器盛放的液体是( )
| A、稀盐酸 |
| B、稀硝酸 |
| C、FeCl3溶液 |
| D、浓H2SO4 |
下列物质溶于水的电离方程式正确的是( )
| A、KHCO3═K++H++CO32- |
| B、H2S═2H++S2- |
| C、KHSO4═K++H++SO42- |
| D、Ba(OH)2=Ba2++(OH)2- |
向明矾[KAl(SO4)2?12H2O]溶液中滴入Ba(OH)2溶液时,当SO42-沉淀完全时,铝元素的存在形式是( )
| A、一部分为Al(OH)3沉淀,一部分以Al3+形式存在于溶液中 |
| B、一部分为Al(OH)3沉淀,一部分以[Al(OH)4]-形式存在于溶液中 |
| C、全部为Al(OH)3沉淀 |
| D、几乎全部以[Al(OH)4]-存在于溶液中 |
下列说法正确的是( )
| A、124gP4含有的P-P键的个数为6NA |
| B、12g石墨中含有的C-C键的个数为2NA |
| C、12g金刚石中含有的C-C键的个数为1.5NA |
| D、60gSiO2中含Si-O键的个数为2NA |
下列有关氧化还原反应的叙述中,正确的是( )
| A、一定有氧元素参加 |
| B、一定有电子转移(得失或偏移) |
| C、氧化反应一定先于还原反应发生 |
| D、氧化剂本身发生氧化反应 |
25℃,弱酸的电离平衡常数Ka如表所示,下列说法正确的是( )
| 弱酸 | CH3COOH | HCN | H2CO3 |
| Ka | 1.8×10-5 | 4.9×10-10 | K1:4.3×10-7 K2:5.6×10-11 |
| A、pH相同的三种溶液物质的量浓度关系:c(Na2CO3)>c(NaCN)>c(CH3COONa) |
| B、a L 0.1mol?L-1CH3COOH与b L 0.1mol?L-1NaOH溶液混合后所得溶液中pH>7,则a一定小于或等于b |
| C、物质的量浓度和体积均相同的CH3COONa和NaOH两种溶液,已知前者溶液中离子数目为n1,后者溶液中离子数目为n2,则n1>n2 |
| D、物质的量浓度相同NaHCO3和Na2CO3的混合溶液中:2c(H+)-2c(OH-)=c(CO32-)-c(HCO3-)-c(H2CO3) |
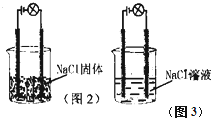 某化学兴趣小组进行化学实验,按照图2连接好线路发现灯泡不亮,按照图3连接好线路发现灯泡亮,由此得出的结论不正确的是( )
某化学兴趣小组进行化学实验,按照图2连接好线路发现灯泡不亮,按照图3连接好线路发现灯泡亮,由此得出的结论不正确的是( )| A、NaCl是电解质 |
| B、NaCl溶液是电解质 |
| C、NaCl在水溶液中电离出可以自由移动的离子 |
| D、NaCl溶液可以导电 |