题目内容
 请运用化学反应原理的相关知识研究碳及其化合物的性质.
请运用化学反应原理的相关知识研究碳及其化合物的性质.(1)工业上一般以CO和H2为原料合成甲醇,在恒容容器中,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ?mol-1
①下列措施中能说明反应达到平衡状态的是
A.体系压强保持不变
B.混合气体的密度保持不变
C.CO与H2的浓度之比为1:2
D.单位时间内,消耗2molH2的同时消耗1mol CH3OH
②在恒容容器中合成甲醇,当温度分别为230℃、250℃和270℃时,CO的转化率与n(H2)/n(CO)的起始组成比的关系如图所示.已知容器体积1L,起始时CO的物质的量均为1mol.据此判断在上述三种温度中,曲线Z对应的温度是
(2)已知:CO(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气的热化学方程式为
考点:化学平衡状态的判断,热化学方程式,转化率随温度、压强的变化曲线
专题:化学反应中的能量变化,化学平衡专题
分析:(1)①化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论;
②正反应放热,则升高温度CO的转化率降低;计算出平衡时各物质的浓度,结合平衡常数的定义进行计算;
(2)根据盖斯定律进行计算,书写热化学方程式.
②正反应放热,则升高温度CO的转化率降低;计算出平衡时各物质的浓度,结合平衡常数的定义进行计算;
(2)根据盖斯定律进行计算,书写热化学方程式.
解答:
解:(1)①A.反应前后气体的体积不等,故体系压强保持不变可作为判断是否达到化学平衡状态的依据,故A正确;
B.密度=
,总质量不变,体积也不变,故混合气体的密度保持不变不能作为判断是否达到化学平衡状态的依据,故B错误;
C.各物质的浓度之比取决于物质的起始物质的量和转化率,故CO与H2的浓度之比为1:2不能作为判断是否达到平衡状态的依据,故C错误,
D.单位时间内,消耗2molH2是正反应,同时消耗1molCH3OH是逆反应,且化学反应速率之比等于化学计量数之比,故正逆反应速率相等,故D正确,
故答案为:AD;
②根据该反应为放热反应,温度越高CO的转化率越小,所以曲线Z为270℃,
由图象可知当270℃时,CO的转化率为50%,n(H2):n(CO)=1.5,则
CO(g)+2H2(g)?CH3OH (g)
起始(mol/L) 1 1.5 0
转化(mol/L) 0.5 1 0.5
平衡(mol/L) 0.5 0.5 0.5
K=
=
=4,
故答案为:270℃;4;
(2)①CO(g)+
O2(g)═CO2(g)△H2=-283kJ?mol-1;
②H2(g)+
O2(g)═H2O(g)△H3=-242kJ?mol-1;
③CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ?mol-1
①+②×2-③得:CH3OH(g)+3/2O2(g)?CO2(g)+2H2O(g)△H=-651kJ?mol-1,
故答案为:CH3OH(g)+
O2(g)?CO2(g)+2H2O(g)△H=-651kJ?mol-1.
B.密度=
| 总质量 |
| 体积 |
C.各物质的浓度之比取决于物质的起始物质的量和转化率,故CO与H2的浓度之比为1:2不能作为判断是否达到平衡状态的依据,故C错误,
D.单位时间内,消耗2molH2是正反应,同时消耗1molCH3OH是逆反应,且化学反应速率之比等于化学计量数之比,故正逆反应速率相等,故D正确,
故答案为:AD;
②根据该反应为放热反应,温度越高CO的转化率越小,所以曲线Z为270℃,
由图象可知当270℃时,CO的转化率为50%,n(H2):n(CO)=1.5,则
CO(g)+2H2(g)?CH3OH (g)
起始(mol/L) 1 1.5 0
转化(mol/L) 0.5 1 0.5
平衡(mol/L) 0.5 0.5 0.5
K=
| c(CH3OH) |
| c(CO)?c2(H2) |
| 0.5 |
| 0.5×0.5×0.5 |
故答案为:270℃;4;
(2)①CO(g)+
| 1 |
| 2 |
②H2(g)+
| 1 |
| 2 |
③CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ?mol-1
①+②×2-③得:CH3OH(g)+3/2O2(g)?CO2(g)+2H2O(g)△H=-651kJ?mol-1,
故答案为:CH3OH(g)+
| 3 |
| 2 |
点评:本题考查化学平衡的标志判断、影响化学平衡的因素、平衡常数的计算以及盖斯定律的计算,综合性较强,难度中等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
下列叙述正确的是( )
| A、Na2CO3和NaHCO3的混合溶液中一定存在:c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-) |
| B、1mol Cl2通入含1mol FeBr2的溶液中发生反应的离子方程式:Cl2+2Br-=2Cl-+Br2 |
| C、能使甲基橙显红色的溶液中大量存在:Mg2+、I-、Cl-、NO3- |
| D、从C(石墨)=C(金刚石)△H=+1.9kJ?mol-1,可知金刚石比石墨更稳定 |

 (1)已知在一定条件下的反应4HCl+O2=2Cl2+2H2O中,有4mol HCl被氧化时,放出
(1)已知在一定条件下的反应4HCl+O2=2Cl2+2H2O中,有4mol HCl被氧化时,放出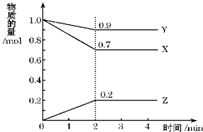 (1)在101kPa时,CO在1.0mol O2中完全燃烧,生成2.0mol CO2,放出566.0kJ的热量,则此反应的热化学方程:
(1)在101kPa时,CO在1.0mol O2中完全燃烧,生成2.0mol CO2,放出566.0kJ的热量,则此反应的热化学方程: 托盘天平、容量瓶、滴定管、量筒是中学化学常见的计量仪器,熟知这些仪器的使用是定量研究化学的基础.
托盘天平、容量瓶、滴定管、量筒是中学化学常见的计量仪器,熟知这些仪器的使用是定量研究化学的基础.