题目内容
1.某学习小组用DIS系统(DIS系统即数字化信息系统,它由传感器、数据采集器和计算机组成)测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力来判断滴定终点.实验步骤如下:
(1)用移液管(填仪器名称)量取10.00mL食用白醋,在烧杯(填仪器名称)中用水稀释后转移到100mL的容量瓶(填仪器名称)中定容,然后将稀释后的溶液倒入试剂瓶中.
(2)量取20.00mL上述溶液倒入烧杯中,连接好DIS系统,向烧杯中滴加浓度为0.1000mol•L-1的氨水,计算机屏幕上显示出溶液导电能力随氨水体积变化的曲线(见图2).
①用滴定管盛氨水前,滴定管要用0.1000mol.l-1润洗2~3遍,润洗的目的是减少实验误差.
②氨水与醋酸反应的离子方程式是CH3COOH+NH3•H2O═CH3COO-+NH4++H2O.
③食用白醋中醋酸的物质的量浓度是1.000 mol.l-1.
分析 (1)根据量取液体体积的精确度以及液体的性质选择仪器;在烧杯中稀释溶液;用容量瓶配制一定浓度的溶液;
(2)①滴定管清洗完之后管壁上残留水,会使待测溶液浓度下降;
②氨水与醋酸反应生成醋酸铵和水;
③根据图表可知当混合液导电能力最强时,醋酸恰好与氨水反应完全,分别求出反应消耗的醋酸的物质的量和氨水的物质的量,依据酸碱中和反应n(CH3COOH)=n(NH3•H2O)计算求解.
解答 解:(1)移液管精确度为0.01ml,根据装置图可知,应选用移液管量取白醋;然后把白醋,转移到烧杯中加水稀释溶液,再把溶液转入100mL容量瓶中中定容;
故答案为:移液管;烧杯;容量瓶;
(2)①为防止滴定管清洗完之后管壁上残留水将待测液稀释,应用所盛0.1000mol•L-1的氨水润洗2-3次,
故答案为:0.1000mol•L-1的氨水;防止氨水被稀释;
②醋酸与氨水反应生成醋酸铵和水,醋酸铵为强电解质,其反应的离子方程式为:CH3COOH+NH3•H2O═CH3COO-+NH4++H2O;
故答案为:CH3COOH+NH3•H2O═CH3COO-+NH4++H2O;
③设白醋的浓度为C,则反应消耗的醋酸的物质的量为n(CH3COOH)=C×10.00mL×$\frac{20}{100}$;反应消耗的氨水的物质的量为:n(NH3•H2O)=0.1000mol•L-1×20ml,根据图表可知当混合液导电能力最强时,醋酸恰好与氨水反应完全,所以n(CH3COOH)=n(NH3•H2O),即C×10.00mL×$\frac{20}{100}$=0.1000mol•L-1×20ml,C=1.000mol•L-1;
故答案为:1.000mol•L-1.
点评 本题考查溶液的配制、中和滴定实验,题目难度中等,注意滴定管的选择和使用的注意事项,溶液的导电性取决于溶液中离子的浓度,侧重于考查学生的实验操作能力.

 阅读快车系列答案
阅读快车系列答案| A. | ⑤①②④③ | B. | ⑤①②④③ | C. | ⑤②①④③ | D. | ④①⑤②③ |
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3.
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中种
化合物的电子式:
 .
.(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用催
化剂为(填序号)ab. a.MnO2b.FeCl3 c.Na2SO3 d.KMnO4
(5)用电子式表示①、④两种元素形成18电子的形成过程
 .
. | A. | PCl5 | B. | BF3 | C. | BeCl2 | D. | NaClO |
| A. | CH≡C-CH2CH3 丁炔 | B. | CH2═CH-CH=CH-CH3 1,3-二戊烯 | ||
| C. | 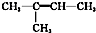 2-甲基丁烯 2-甲基丁烯 | D. | 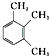 1,2,3-三甲苯 1,2,3-三甲苯 |
| A. | mol/L•s | B. | mol•(L•min)-1 | C. | mol/(L•min) | D. | mol•L-1•s-1 |
| A. | NaI | B. | NaBr | C. | MgI2 | D. | KBr |
| A. | 断开化学键的过程会放出能量 | |
| B. | 吸热反应中,反应物的总能量小于生成物的总能量 | |
| C. | 加热才能发生的反应一定是吸热反应 | |
| D. | 氧化反应均为吸热反应 |