题目内容
5.要配制450mL 0.2mol•L-1FeSO4溶液,实验操作步骤有:①在天平上称取a g绿矾(FeSO4•7H2O),将它放在烧杯中,用适量蒸馏水使其完全溶解 ②将所得溶液沿玻璃棒注入500mL容量瓶中 ③继续向容量瓶中加水至液面距刻度线1-2cm处,改用胶头滴管滴加蒸馏水至凹液面底部与刻度线相切 ④用少量水洗涤烧杯和玻璃棒2-3次,每次洗液都转入容量瓶 ⑤将容量瓶塞紧,充分摇匀填写下列空白
(1)a g绿矾的实际质量为27.8g.
(2)上述操作步骤的正确顺序为①②④③⑤.
(3)下列操作会使所配溶液的浓度偏高的是BD
A.若配制时遗漏步骤④; B.定容时俯视刻度线;
C.称量时物、码放反了; D.绿矾样品已部分风化
E.摇匀后溶液低于刻度线,再加入蒸馏水使液面最低点与刻度线相切;
F.引流时玻璃棒靠在刻度线上方
(4)取一定体积所配制硫酸亚铁的溶液,用一定浓度的酸性KMnO4标准溶液进行滴定,滴定过程中不需要(需要或不需要)指示剂,并说明理由高锰酸钾有很深的紫色,滴定中体现氧化性,被还原后紫色消失或变浅.
分析 (1)要配制450mL 0.2mol•L-1FeSO4溶液,应选择500mL容量瓶,实际配制500mL溶液,依据m=CVM计算需要绿矾的质量;
(2)依据配制一定物质的量浓度溶液的一般步骤排序;
(3)分析操作对溶质的物质的量和溶液的体积,依据C=$\frac{n}{V}$进行误差分析;
(4)高锰酸钾与二价铁离子反应,紫色的高锰酸根离子被还原为无色的二价锰离子.
解答 解:(1)要配制450mL 0.2mol•L-1FeSO4溶液,应选择500mL容量瓶,实际配制500mL溶液,需要溶质的质量m=0.2mol/L×0.5L×278g/mol=27.8g;
故答案为:27.8;
(2)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,所以正确的操作为:①②④③⑤;
故答案为:①②④③⑤;
(3)A.若配制时遗漏步骤④,导致溶质的物质的量偏小,溶液浓度偏低,不A不选;
B.定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故B选;
C.依据左盘质量=右盘质量+游码质量,所以称量时物、码放反了,实际称量的固体为27-0.8=26.2g,溶质的物质的量偏小,溶液浓度偏低,故C不选;
D.绿矾样品已部分风化,27.8g固体中含有的溶质的物质的量偏大,溶液浓度偏高,故D选;
E.摇匀后溶液低于刻度线,再加入蒸馏水使液面最低点与刻度线相切,导致溶液体积偏大,溶液浓度偏低,故E不选;
F.玻璃棒在刻度线上方引流水,则易造成刻度线上方水有粘留,故定容完成后溶液体积会偏大,浓度会偏小,故F不选;
故选:D;
(4)高锰酸钾与二价铁离子反应,紫色的高锰酸根离子被还原为无色的二价锰离子,溶液颜色变为无色或者变浅,所以不需要加入指示剂;
故答案为:不需要;高锰酸钾有很深的紫色,滴定中体现氧化性,被还原后紫色消失或变浅.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和过程是解题关键,注意容量瓶、量筒规格选择的依据,注意误差分析的方法和技巧,题目难度不大.

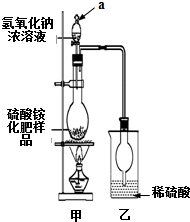 硫酸铵是一种常用的铵态氮肥.国家规定的质量标准如下:
硫酸铵是一种常用的铵态氮肥.国家规定的质量标准如下:| 指标 项目 | 优等品 | 一等品 | 合格品 |
| 外 观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥21.0% | ≥20.5% |
[观察外观]该硫酸铵化肥无可见机械杂质.
[实验检测]
(1)通常实验室检验某样品是否为铵盐,是将样品与B(填序号,下同)共热,并用C或E检验产生的气体.
A.强酸 B.强碱 C.湿润的红色石蕊试纸D.湿润的蓝色石蕊试纸
E.用蘸有浓盐酸的玻璃棒 F.用蘸有浓硫酸的玻璃棒
(2)若按图所示装置进行实验.仪器a的名称是分液漏斗;烧瓶内发生反应的离子方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(3)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热,原因是:使硫酸铵充分反应完全转化为NH3,且全部进入烧杯乙.
[交流讨论]
(4)某同学根据此实验测得的数据,计算硫酸铵化肥的含氮量偏高(>21.2%),请分析实验装置中存在一个明显缺陷是:甲、乙装置间缺一个干燥装置.
[探究结论]
(5)用改进后的实验装置重新进行实验.称取13.5g硫酸铵化肥样品,测得实验前后乙装置增重3.40g.该化肥不是(填“是”或“不是”)一等品.
(2)2Ag(s)+$\frac{1}{2}$O2(g)═Ag2O(s),△H=-31.0kJ/mol
则ZnO(s)+2Ag(s)═Zn(s)+Ag2O(s)的△H等于( )
| A. | -317.3kJ/mol | B. | +317.3 kJ/mol | C. | -379.3kJ/mol | D. | -332.8kJ/mol |
| A. | 适量摄入油脂,有助于人体吸收多种脂溶性维生素和胡萝卜素 | |
| B. | 利用油脂在碱性条件下的水解,可以生产甘油和肥皂 | |
| C. | 植物油通过氢化可以制造植物奶油(人造奶油) | |
| D. | 脂肪是有机体组织里储存能量的重要物质 |
| A. | 使酚酞呈红色的溶液:Na+、NH4+、Al3+、NO3- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1mol•L-1的溶液:Na+、K+、CO32-、ClO- | |
| C. | 含有Fe3+的溶液:Na+、Al3+、Cl-、SCN- | |
| D. | 由水电离产生的c(OH-)=1×10-14mol•L-1溶液:K+、Na+、Cl-、HCO3- |
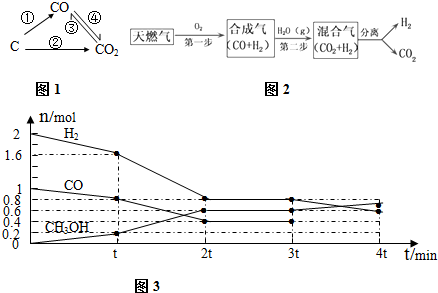
(1)图1为碳及其氧化物的变化关系图,若①变化是置换反应则其化学方程式可为(写一个即可)C+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO;写出实验室检验CO2气体的离子反应方程式:①③
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:CO(g)+$\frac{1}{2}$O2?CO(g)降低其浓度.某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示.请填写表中的空格.
| 容器编号 | c(CO)/mol.L-1 | c(O2)/mol.L-1 | (CO2)/mol.L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正)>v(逆) |
CH4在催化剂作用下实现第一步,也叫CH4不完全燃烧,1gCH4不完全燃烧反应放出2.21kJ热量,写出该反应的热化学方程式2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-70.72kJ•mol-1.
(4)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用(3)转化中得到的合成气制备甲醇.反应为CO(g)+2H2(g)?CH3OH(g) 某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见图3:
①根据图3计算,从反应开始到t min时,用H2浓度变化表示的平均反应速率v(H2)=$\frac{1}{5t}$mol/(L•min)
②t min至2t min时速率变化的原因可能是反应受热或使用了催化剂;
③3t min时对反应体系改变了一个条件,至4t min时CO的物质的量为0.5mol,
请画出图3中3tmin 到4t min内CO的物质的量随时间变化的曲线.
(5)某同学按图所示的装置用甲醇燃料电池(装置I)进行电解的相关操作,以测定铜的相对原子质量,其中c电极为铜棒,d电极为石墨,X溶液为500mL 0.4mol/L硫酸铜溶、液.当装置II中某电极上收集到标准状况下的气体V1mL时,另一电极增重mg(m<12.8).
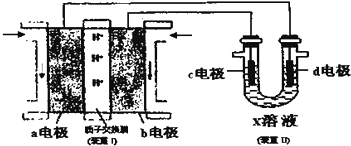
①装置I中、H+向a极(填“a”或“b”)移动;b电极上发生的反应为CH3OH-6eˉ+H2O=CO2+6H+.
②铜的相对原子质量的表达式为$\frac{11200m}{{V}_{1}}$ (用m和V1的代数式表示).

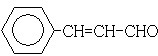 ;
; ;
; 、
、 、
、 、
、 (其中任意两种).
(其中任意两种).