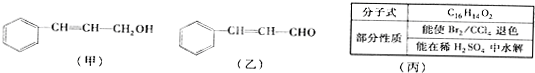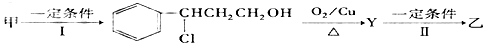题目内容
表是元素周期表的一部分,针对表中所列①~⑩元素,填写下列空白.
(1)单质性质最不活泼的元素的原子电子式是 .
(2)地壳中含量最多的元素在元素周期表中的位置为第 周期 族.
(3)元素①的气态氢化物的化学式为 ,其中含有的化学键的类型为 .
(4)第三周期元素的最高价氧化物对应水化物中,碱性最强的是 (填化学式),
(5)元素⑦的氧化物与氢氧化钠溶液反应的离子方程式是 .
(6)某元素二价阳离子的核外有10个电子,该阳离子的离子符号是 .
(7)用电子式表示元素⑤与④的化合物的形成过程: ,
(8)工业上用②元素的单质合成其氢化物的化学方程式是 .
(9)③、④、⑧的气态氢化物的稳定性由强到弱为: (填化学式)
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | ||||||||
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)地壳中含量最多的元素在元素周期表中的位置为第
(3)元素①的气态氢化物的化学式为
(4)第三周期元素的最高价氧化物对应水化物中,碱性最强的是
(5)元素⑦的氧化物与氢氧化钠溶液反应的离子方程式是
(6)某元素二价阳离子的核外有10个电子,该阳离子的离子符号是
(7)用电子式表示元素⑤与④的化合物的形成过程:
(8)工业上用②元素的单质合成其氢化物的化学方程式是
(9)③、④、⑧的气态氢化物的稳定性由强到弱为:
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中的位置,可知①为C、②为N、③为O、④为F、⑤为Na、⑥为Mg、⑦为Al、⑧为S、⑨为Cl、⑩为Ar.
(1)稀有气体Ar的化学性质最不活泼,Ar原子最外层有8个电子;
(2)地壳中含量最多的元素是氧元素;
(3)元素①的气态氢化物为甲烷,含有极性键;
(4)金属性越强,最高价氧化物对应水化物的碱性越强;
(5)氧化铝与氢氧化钠溶液反应生成偏铝酸钠与水;
(6)某元素二价阳离子的核外有10个电子,该元素为Mg;
(7)元素⑤与④的化合物为NaF,由钠离子与氟离子构成,用Na原子、F原子电子式表示其形成过程;
(8)氮气与氨气在高温高压、催化剂条件下生成氨气;
(9)非金属性越强,氢化物越稳定.
(1)稀有气体Ar的化学性质最不活泼,Ar原子最外层有8个电子;
(2)地壳中含量最多的元素是氧元素;
(3)元素①的气态氢化物为甲烷,含有极性键;
(4)金属性越强,最高价氧化物对应水化物的碱性越强;
(5)氧化铝与氢氧化钠溶液反应生成偏铝酸钠与水;
(6)某元素二价阳离子的核外有10个电子,该元素为Mg;
(7)元素⑤与④的化合物为NaF,由钠离子与氟离子构成,用Na原子、F原子电子式表示其形成过程;
(8)氮气与氨气在高温高压、催化剂条件下生成氨气;
(9)非金属性越强,氢化物越稳定.
解答:
解:由元素在周期表中的位置,可知①为C、②为N、③为O、④为F、⑤为Na、⑥为Mg、⑦为Al、⑧为S、⑨为Cl、⑩为Ar.
(1)稀有气体Ar原子最外层有8个电子,化学性质最不活泼,其电子式为: ,故答案为:
,故答案为: ;
;
(2)地壳中含量最多的元素是氧元素,处于周期表中第二周期ⅥA族,故答案为:二;ⅥA;
(3)元素①的气态氢化物为CH4,含有极性键,故答案为:CH4;极性键;
(4)同周期自左而右金属性减弱,第三周期中Na的金属性最强,金属性越强,最高价氧化物对应水化物的碱性越强,故NaOH的碱性最强,故答案为:NaOH;
(5)氧化铝与氢氧化钠溶液反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(6)某元素二价阳离子的核外有10个电子,该元素为Mg,该阳离子的离子符号是Mg2+,故答案为:Mg2+;
(7)元素⑤与④的化合物为NaF,由钠离子与氟离子构成,用Na原子、F原子电子式表示其形成过程为: ,
,
故答案为: ;
;
(8)氮气与氨气在高温高压、催化剂条件下生成氨气,反应方程式为:N2+3H2 2NH3,故答案为:N2+3H2
2NH3,故答案为:N2+3H2 2NH3;
2NH3;
(9)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故非金属性F>O>S,非金属性越强,氢化物越稳定,故氢化物稳定性:HF>H2O>H2S,
故答案为:HF>H2O>H2S.
(1)稀有气体Ar原子最外层有8个电子,化学性质最不活泼,其电子式为:
 ,故答案为:
,故答案为: ;
;(2)地壳中含量最多的元素是氧元素,处于周期表中第二周期ⅥA族,故答案为:二;ⅥA;
(3)元素①的气态氢化物为CH4,含有极性键,故答案为:CH4;极性键;
(4)同周期自左而右金属性减弱,第三周期中Na的金属性最强,金属性越强,最高价氧化物对应水化物的碱性越强,故NaOH的碱性最强,故答案为:NaOH;
(5)氧化铝与氢氧化钠溶液反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(6)某元素二价阳离子的核外有10个电子,该元素为Mg,该阳离子的离子符号是Mg2+,故答案为:Mg2+;
(7)元素⑤与④的化合物为NaF,由钠离子与氟离子构成,用Na原子、F原子电子式表示其形成过程为:
 ,
,故答案为:
 ;
;(8)氮气与氨气在高温高压、催化剂条件下生成氨气,反应方程式为:N2+3H2
 2NH3,故答案为:N2+3H2
2NH3,故答案为:N2+3H2 2NH3;
2NH3;(9)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故非金属性F>O>S,非金属性越强,氢化物越稳定,故氢化物稳定性:HF>H2O>H2S,
故答案为:HF>H2O>H2S.
点评:本题考查元素周期表与元素周期律的综合应用,侧重对化学用语及元素周期律的考查,注意掌握用电子式表示化学键或物质的形成,难度不大.

练习册系列答案
相关题目
苯和甲苯相比较,下列叙述中不正确的是( )
| A、都属于芳香烃 |
| B、都能在空气中燃烧 |
| C、都能使KMnO4酸性溶液褪色 |
| D、都能发生取代反应 |
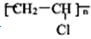 )就是以乙炔为原材料制得的.写出以乙炔和HCl为原料制聚氯乙烯的化学方程式.
)就是以乙炔为原材料制得的.写出以乙炔和HCl为原料制聚氯乙烯的化学方程式.