题目内容
17.由碳棒、铁片和200mL 1.5mol/L的稀硫酸组成的原电池中,当在碳棒上产生气体3.36L(标准状况)时,求:(1)有1.806×1023个电子通过了导线.(NA=6.02×1023)
(2)此时溶液中H+的物质的量浓度为1.5mol/L(不考虑溶液体积变化).
分析 (1)该原电池的碳棒为正极,是氢离子得电子的还原反应,根据关系式2H++2e-=H2↑计算转移电子数目;
(2)根据生成的氢气计算出参加反应的H+的物质的量,计算出溶液中H+的物质的量浓度变化量,原稀硫酸溶液中H+的物质的量浓度减去溶液中H+的物质的量浓度变化量,即为所求溶液中H+的物质的量浓度.
解答 解:(1)碳棒上产生气体3.36L为氢气,根据关系式2H++2e-=H2↑可知反应转移的电子的物质的量为$\frac{3.36L}{22.4L/mol}$×2=0.3mol,所以电线中通过的电子数目为0.3mol×6.02×1023mol-1=1.806×1023,
故答案为:1.806×1023;
(2)根据H原子守恒可知,参加反应H+的物质的量为为$\frac{3.36L}{22.4L/mol}$×2=0.3mol,H+的物质的量浓度变化量△c(H+)=$\frac{0.3mol}{0.2L}$=1.5mol/L,所以液中H+的物质的量浓度c(H+)=1.5mol/L×2-1.5mol/L=1.5mol/L,
故答案为:1.5mol/L.
点评 本题考查原电池的工作原理,涉及电子转移的计算,溶液中离子浓度的变化,属于基础知识,难度较小.

练习册系列答案
相关题目
8.下列粒子在一定条件下,既可以做氧化剂,又可以做还原剂的是( )
| A. | Fe2+ | B. | H2O | C. | Fe | D. | Cl- |
5.据报道,科学家发现了新的氢粒子,这种粒子是由3个氢原子核(只含质子)和2个电子构成的,这对解释宇宙演化提供了新的参考.对于这种氢粒子,下列说法错误的是( )
| A. | 它的组成可以用H3+表示 | B. | 它比普通氢分子多一个氢原子核 | ||
| C. | 它一定含3个中子 | D. | 可以推测它的化学性质与H2不同 |
12.化学与人类生活密切相关,下列说法正确的是( )
| A. | 苯酚有一定毒性,不能用作消毒剂和防腐剂 | |
| B. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| C. | 乙醇和乙酸都是常用调味品的主要成分 | |
| D. | 油脂是人体需要的重要的营养成分,属于天然高分子化合物 |
2.设NA表示阿伏伽德罗常数,下列叙述中正确的是( )
| A. | 常温常压下,11.2L氧气中所含有的原子数为NA | |
| B. | 17g的NH3分子中含有的电子数为10NA | |
| C. | 常温常压下,48g O3含有的氧原子数为3NA | |
| D. | 标准状况下,11.2LH2O中所含有的分子数为0.5NA |
6.氯原子参与破坏O3的反应
O3+Cl→ClO+O2△H1
ClO+O→Cl+O2△H2
破坏臭氧层的总反应是:O3+O→2O2 △H
该反应的能量变化示意图如图所示: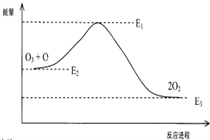
则下列叙述不正确的是( )
O3+Cl→ClO+O2△H1
ClO+O→Cl+O2△H2
破坏臭氧层的总反应是:O3+O→2O2 △H
该反应的能量变化示意图如图所示:

则下列叙述不正确的是( )
| A. | △H=△H1+△H2 | |
| B. | ClO中含有极性共价键 | |
| C. | 反应O3+O→2O2的△H=E1-E3 | |
| D. | 氯原子改变了该反应的历程,但不影响△H |
3.下列烃在光照下与氯气反应,只生成一种一氯代物的有( )
| A. | 2-甲基丙烷 | B. | 甲基环戊烷 | C. | 2,2-二甲基丁烷 | D. | 2,2-二甲基丙烷 |
4.质谱显示,某有机化合物的相对分子质量为46,燃烧实验发现其分子中碳、氢原子数之比为1:3,核磁共振谱显示,该物质中只有一种类型的氢原子.关于该化合物的描述中,正确的是( )
| A. | 该化合物为乙醇 | B. | 该化合物与乙醇互为同分异构体 | ||
| C. | 该化合物为乙醚 | D. | 该化合物与乙醚互为同分异构 |
 ;
;