题目内容
下列说法正确的是( )
| A、体系中气体的密度发生变化,说明反应没有达到平衡状态 |
| B、体系中各组分的体积分数发生变化,说明平衡发生了移动 |
| C、△S>0的反应一定是自发反应 |
| D、反应达到平衡状态时,正、逆反应速率均为0 |
考点:化学平衡状态的判断,焓变和熵变
专题:
分析:A.如气体的总质量不变,改变体积平衡不移动,则密度变化,但仍未平衡状态;
B.体系中各组分的体积分数发生变化,说明各物质的量变化;
C.反应能否自发进行,取决于焓变和熵变的综合判据;
D.反应达到平衡状态,反应并没有停止.
B.体系中各组分的体积分数发生变化,说明各物质的量变化;
C.反应能否自发进行,取决于焓变和熵变的综合判据;
D.反应达到平衡状态,反应并没有停止.
解答:
解:A.如反应I2(g)+H2(g)?2HI(g),改变压强,平衡不移动,但密度改变,故A错误;
B.体系中各组分的体积分数发生变化,说明各物质的量变化,则平衡发生了移动,故B正确;
C.反应能否自发进行,取决于焓变和熵变的综合判据,当△H-T?△S<0时,可自发进行,如△S>0,但△H>0,不一定能自发进行,故C错误;
D.反应达到平衡状态,反应并没有停止,故D错误.
故选B.
B.体系中各组分的体积分数发生变化,说明各物质的量变化,则平衡发生了移动,故B正确;
C.反应能否自发进行,取决于焓变和熵变的综合判据,当△H-T?△S<0时,可自发进行,如△S>0,但△H>0,不一定能自发进行,故C错误;
D.反应达到平衡状态,反应并没有停止,故D错误.
故选B.
点评:本题综合考查化学平衡移动以及反应热与焓变等问题,多角度考查化学反应原理,为高频考点,注意相关基础知识的积累,难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
常温下,经测定某溶液中离子只有Na+、CH3COO-、H+、OH-四种,且离子浓度大小的排列顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-).其可能的情形是( )
| A、该溶液中由水电离的c(H + ) 一定小于 10 -7 mol/L |
| B、该溶液由0.1 mol?L-1的CH3COOH溶液与等物质的量浓度、等体积的NaOH溶液混合而成 |
| C、该溶液中的溶质可能是CH3COOH和CH3COONa |
| D、在上述溶液中加入适量盐酸,可使溶液中离子浓度改变为c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
某学生设计了如图的方法对A盐进行鉴定:由此分析,下列结论中,正确的是( )


| A、A中一定有Fe3+ |
| B、B为AgI沉淀 |
| C、C中一定有Fe3+ |
| D、A一定为FeBr2溶液 |
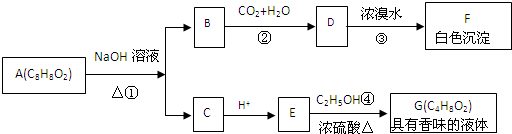

 A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,E(C4H8O2)是具有果香气味的液体.A、B、C、D在一定条件下有如下转化关系(部分反应条件、产物被省略)
A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,E(C4H8O2)是具有果香气味的液体.A、B、C、D在一定条件下有如下转化关系(部分反应条件、产物被省略)