��Ŀ����
��֪��ȡ����Ҳ����Ũ������������Ϊԭ�ϣ��仯ѧ����ʽΪ��2KMnO4+16HCl��Ũ��=2MnCl2+2KCl+5Cl2��+8H2O����ش��������⣺
��1����˫���ŷ�����û�ѧʽ����ת�Ƶķ�������Ŀ��2KMnO4+16HCl��Ũ��=2MnCl2+2KCl+5Cl2��+8H2O��
��2����Ӧ�б���ԭ��Ԫ��Ϊ ��д���ƣ�����״���µ�����112L����ʱ����Ӧ��ת�Ƶĵ�����ĿΪ ��
��3������4molHCl��������������ɱ�״���µ����� L��
��4������1.58g������غ�100mL10moL/LŨ�����ַ�Ӧ������������ӷ���������Һ�����ǰ��仯������Ӧ���յ�ʱ���������ɫ��ȫ��ȥ����������HCl�����ʵ���Ϊ mol������Ӧ�����Һȡ��10mL��������������������Һ���ɵõ����������ʵ���Ϊ mol��
��1����˫���ŷ�����û�ѧʽ����ת�Ƶķ�������Ŀ��2KMnO4+16HCl��Ũ��=2MnCl2+2KCl+5Cl2��+8H2O��
��2����Ӧ�б���ԭ��Ԫ��Ϊ
��3������4molHCl��������������ɱ�״���µ�����
��4������1.58g������غ�100mL10moL/LŨ�����ַ�Ӧ������������ӷ���������Һ�����ǰ��仯������Ӧ���յ�ʱ���������ɫ��ȫ��ȥ����������HCl�����ʵ���Ϊ
���㣺������ԭ��Ӧ�ļ���,������ʵ�����Ʒ�
ר�⣺������ԭ��Ӧר��,±��Ԫ��
��������Ӧ2KMnO4+16HCl��Ũ��=2MnCl2+2KCl+5Cl2��+8H2O�У�MnԪ�ػ��ϼ���+7�۽��͵�+2�ۣ�����ԭ��KMnO4Ϊ��������ClԪ�ػ��ϼ���-1�����ߵ�0�ۣ���������HClΪ��ԭ�����ɷ���ʽ��֪����2molKMnO4�μӷ�Ӧ����16molHCl�μӷ�Ӧ������5molCl2��˵����10molHCl����������Ϸ�Ӧ�ķ���ʽ�����⣮
���
�⣺��1����Ԫ�ػ��ϼ۴�+7�۽��͵�+2�ۣ���Ԫ�ػ��ϼ۴�-1������Ϊ0�ۣ�˫���ű�ʾΪ��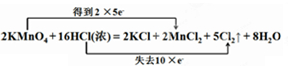 ��
��
�ʴ�Ϊ�� ��
��
��2����Ӧ����Ԫ�ػ��ϼ۽��ͣ�����ԭ��n��Cl2��=
=5mol��ClԪ�ػ��ϼ���-1�����ߵ�0�ۣ���ת�Ƶ��ӵ����ʵ���Ϊ10mol��ת�Ƶ��ӵ���ĿΪ10NA��
�ʴ�Ϊ���̣�10NA��
��3���ɷ���ʽ��֪��10molHCl������������5mol��������4molHCl����������2mol���������Ϊ2mol��22.4L/mol=44.8L��
�ʴ�Ϊ��44.8��
��4��n��KMnO4��=
=0.01mol��n��HCl��=0.1L��10mol/L=1mol��
2KMnO4+16HCl��Ũ��=2MnCl2+2KCl+5Cl2��+8H2O ������HCl
2 16 10
0.01mol 0.08mol 0.05mol��
��Ӧ����Һʣ��n��Cl-��=1mol-0.05mol=0.95mol��
����Ӧ�����Һȡ��10mL������n��Cl-��=0.095mol��
��n��AgCl��=0.095mol��
�ʴ�Ϊ��0.05mol��0.095��
 ��
���ʴ�Ϊ��
 ��
����2����Ӧ����Ԫ�ػ��ϼ۽��ͣ�����ԭ��n��Cl2��=
| 112L |
| 22.4L/mol |
�ʴ�Ϊ���̣�10NA��
��3���ɷ���ʽ��֪��10molHCl������������5mol��������4molHCl����������2mol���������Ϊ2mol��22.4L/mol=44.8L��
�ʴ�Ϊ��44.8��
��4��n��KMnO4��=
| 1.58g |
| 158g/mol |
2KMnO4+16HCl��Ũ��=2MnCl2+2KCl+5Cl2��+8H2O ������HCl
2 16 10
0.01mol 0.08mol 0.05mol��
��Ӧ����Һʣ��n��Cl-��=1mol-0.05mol=0.95mol��
����Ӧ�����Һȡ��10mL������n��Cl-��=0.095mol��
��n��AgCl��=0.095mol��
�ʴ�Ϊ��0.05mol��0.095��
���������⿼��������ԭ��Ӧ����ؼ��㣬������ѧ���ķ��������ͼ��������Ŀ��飬Ϊ��Ƶ���㣬ע�����Ԫ�صĻ��ϼ۵ı仯��Ϊ������Ĺؼ�������ע��ע���Ϸ���ʽ���㣬�ѶȲ���

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
��֪X��Y��Z��W���ֶ�����Ԫ�������ڱ��е����λ����ͼ��ʾ������˵������ȷ���ǣ�������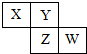
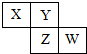
| A��ZԪ�ص�ԭ�Ӱ뾶��YԪ�صĴ� |
| B����Y����ͻ��ϼ�Ϊ-2����W����������ϼ�Ϊ+6 |
| C����Z����������ϼ�Ϊ+5����XԪ�صĻ�������� |
| D����HmZOnΪǿ�ᣬ��Y�ǻ��÷ǽ���Ԫ�� |
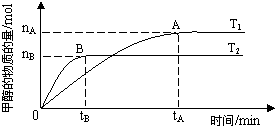
 �ں����ܱ�������ͨ��X��������Ӧ��2X��g��?Y��g�����¶�T1��T2��X�����ʵ���Ũ��c��X����ʱ��t�仯��������ͼ��ʾ������������ȷ���ǣ�������
�ں����ܱ�������ͨ��X��������Ӧ��2X��g��?Y��g�����¶�T1��T2��X�����ʵ���Ũ��c��X����ʱ��t�仯��������ͼ��ʾ������������ȷ���ǣ�������| A���÷�Ӧ���е�M��ų����������ڽ��е�W��ų������� | ||
B��T2�£���0��t1ʱ���ڣ�v��Y��=
| ||
| C��M�������Ӧ����V������N����淴Ӧ����V�� | ||
| D��M��ʱ�ټ���һ����X��ƽ���X��ת���ʼ�С |
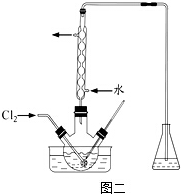
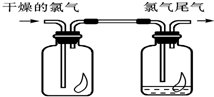 ��1����ͼ��ʾ������������ͨ��ʢ�и�����ɫ�����Ĺ��ƿ��ʢ�г�ʪ��ɫ�����Ĺ��ƿ���ɹ۲쵽��������
��1����ͼ��ʾ������������ͨ��ʢ�и�����ɫ�����Ĺ��ƿ��ʢ�г�ʪ��ɫ�����Ĺ��ƿ���ɹ۲쵽��������