题目内容
17.设NA代表阿伏加德罗常数,下列说法正确的是( )| A. | 2.3克金属钠在干燥空气中被氧化成氧化物时失去的电子数目为0.1NA | |
| B. | 18克水所含的质子数目为NA | |
| C. | 在常温常压下,11.2升氯气所含的分子数目为0.5NA | |
| D. | 32克臭氧所含的原子数目为NA |
分析 A、求出钠的物质的量,然后根据钠反应后变为+1价来分析;
B、求出水的物质的量,然后根据水为10质子微粒来分析;
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、臭氧分子由氧原子构成.
解答 解:A、2.3g钠的物质的量为0.1mol,而钠反应后变为+1价,故0.1mol钠失去0.1mol电子即0.1NA个,故A正确;
B、18g水的物质的量为1mol,而水为10质子微粒,故1mol水中含10NA个质子,故B错误;
C、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氯气的物质的量小于0.5mol,则含有的分子个数小于0.5NA个,故C错误;
D、臭氧分子由氧原子构成,故32g臭氧中含有的氧原子的物质的量为n=$\frac{32g}{16g/mol}$=2mol,故含2NA个氧原子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
3.我国预计在2020年前后建成自己的载人空间站.为了实现空间站的零排放,循环利用人体呼出的C02并提供02,我国科学家设计了一种装置(如图),实现了“太阳能一电能一化学能”转化,总反应方程式为2C02=2C0+02.关于该装置的下列说法正确的是( )
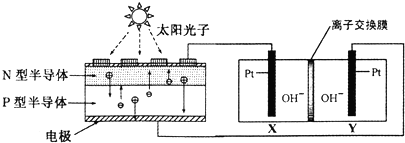

| A. | 图中N型半导体为正极,P型半导体为负极 | |
| B. | 图中离子交换膜为阳离子交换膜 | |
| C. | 反应完毕,该装置中电解质溶液的碱性增强 | |
| D. | 人体呼出的气体参与X电极的反应:CO2+2e一+H2O═CO+2OH- |
12.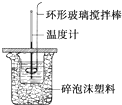 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50mL 0.50mol•L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL 0.55mol•L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?确保盐酸被完全中和.
(2)倒入NaOH溶液的正确操作是C(填序号).
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是D(填序号).
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
实验数据如表:
①填写表中的空白:
②近似地认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃),则中和热△H=-56.8kJ/mol(取小数点后一位).
③中和热测定实验中,下列操作一定会降低实验准确性的是B.
A.用滴定管(精量仪器,读数保留到0.01)取所用酸碱溶液的体积
B.NaOH溶液在倒入小烧杯时,有少量溅出
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D.测量HCl溶液的温度计用水洗净后才用来测NaOH溶液的温度.
 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:①用量筒量取50mL 0.50mol•L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL 0.55mol•L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?确保盐酸被完全中和.
(2)倒入NaOH溶液的正确操作是C(填序号).
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是D(填序号).
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
实验数据如表:
①填写表中的空白:
| 温度 实验次数 | 超始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | / |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
③中和热测定实验中,下列操作一定会降低实验准确性的是B.
A.用滴定管(精量仪器,读数保留到0.01)取所用酸碱溶液的体积
B.NaOH溶液在倒入小烧杯时,有少量溅出
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D.测量HCl溶液的温度计用水洗净后才用来测NaOH溶液的温度.
9.下列用连线方法对部分化学知识进行归纳的内容中,有错误的组是( )
| A. | 物质的性质与用途: 磺胺类药物能抑制细菌合成核酸--治疗肺炎、脑膜炎、尿路感染、呼吸道感染 酸能与碱中和-----胃酸过多的病人服用含氢氧化钠的药物 | |
| B. | 保护环境: 控制“白色污染”--减少和控制使用所有塑料制品 防止水的污染--提倡使用无磷洗衣粉 | |
| C. | 基本安全常识: 饮用假酒中毒--由甲醇引起 食用假盐中毒--由亚硝酸钠引起 | |
| D. | 生活中的一些做法: 除去衣服上的油污--可用汽油洗涤 使煤燃烧更旺--可增大煤与空气接触面积 |
6.无机化合物可根据其组成和性质进行分类,如:
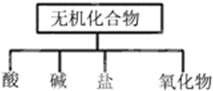
(1)如图所示的物质分类方法名称是树状分类法.
(2)以Na、K、H、O、C、S、N中任意两种或三种元素组成合适的物质,分别填在下表②③⑥的后面.
(3)写出⑦转化为⑤的化学方程式Na2O+CO2═Na2CO3.
(4)实验室制备⑦检验该气体的方法是将气体通入澄清的石灰水中,变浑浊,则说明该气体是二氧化碳.

(1)如图所示的物质分类方法名称是树状分类法.
(2)以Na、K、H、O、C、S、N中任意两种或三种元素组成合适的物质,分别填在下表②③⑥的后面.
| 物质 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 | ①HCl ②HNO3 | ③NaOH、KOH或NH3•H2O ④Ba(OH)2 | ⑤Na2CO3 ⑥NaNO3、Na2SO4或NH4NO3 | ⑦CO2 ⑧Na2O |
(4)实验室制备⑦检验该气体的方法是将气体通入澄清的石灰水中,变浑浊,则说明该气体是二氧化碳.
 .
. 常温下,10mL pH均为2的HX、HY两种一元酸溶液,加水稀释过程中溶液的pH随溶液体积变化曲线如图所示.
常温下,10mL pH均为2的HX、HY两种一元酸溶液,加水稀释过程中溶液的pH随溶液体积变化曲线如图所示.
 如图,请读题并填空:在图中,
如图,请读题并填空:在图中,