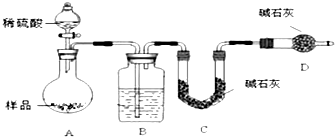
题目内容
7.①钠比水轻;②钠的熔点较低;③钠与水反应时要放出热量;④钠与水反应后溶液呈碱性.某学生将一小块金属钠投入滴有酚酞试液的水中,该实验能证明上述四点性质中的( )| A. | ①④ | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
分析 钠密度小于水,浮在水面上;与水反应生成氢氧化钠和氢气,反应放出大量的热,钠块熔成小球;氢氧化钠属于碱,与酚酞变红色,据此解答.
解答 解:将一小块金属钠投入滴有酚酞溶液的水中,钠块浮在水面上可证明:钠的密度比水小;熔成小球说明;钠的熔点低、钠与水反应时放出热量;溶液变红色,说明钾与水反应后溶液呈碱性,
故选:D.
点评 本题考查钠的性质,题目难度不大,熟悉钠与水反应的现象和性质是解题关键,考查学生对实验分析的能力.

练习册系列答案
相关题目
4.下列有关化学用语表示正确的是
①CSO的电子式: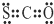
②对硝基苯酚的结构简式: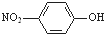
③Cl-的结构示意图: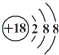
④苯分子的比例模型:
⑤葡萄糖的实验式:CH2O
⑥原子核内有20个中子的氯原子:${\;}_{17}^{20}$Cl
⑦HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+( )
①CSO的电子式:
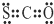
②对硝基苯酚的结构简式:

③Cl-的结构示意图:

④苯分子的比例模型:

⑤葡萄糖的实验式:CH2O
⑥原子核内有20个中子的氯原子:${\;}_{17}^{20}$Cl
⑦HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+( )
| A. | ①④⑤ | B. | ①②③④⑤ | C. | ③⑤⑥⑦ | D. | 全部正确 |
5.FeCO3与砂糖混用可以作补血剂,实验室制备FeCO3的流程如图所示,下列说法正确的是( )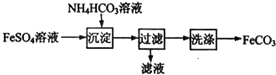

| A. | 过滤操作中所用的玻璃仪器只有烧杯和漏斗 | |
| B. | 产品FeCO3在空气中高温分解可得到纯净的FeO | |
| C. | 可利用HNO3酸化的BaCl2溶液检验FeSO4溶液中的阴离子 | |
| D. | 沉淀过程中有CO2气体放出 |
2.相同状况下,4体积NO2与1.5体积O2混合通过适量水,收集到的气体体积为( )
| A. | 0.5体积 | B. | 2体积 | C. | 3体积 | D. | 4.5体积 |
2.将一定量的氯气通入50mL 10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断正确的是( )
| A. | 与NaOH反应的氯气一定为0.5 mol | |
| B. | 若反应中转移的电子数可能为$\frac{1}{3}$mol | |
| C. | 反应后的溶液中n(Na+)﹕n(Cl-)可能为7﹕6 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11﹕2﹕3 |
12.已知反应 Cl2+NaOH→NaCl+NaClO3+H2O(未配平),下列说法不正确的是( )
| A. | Cl2既是氧化剂也是还原剂 | |
| B. | 被氧化的氯原子数是被还原的氯原子数的5倍 | |
| C. | 当有11.7 g的NaCl生成时,电子转移数为0.2NA | |
| D. | NaCl是还原产物,NaClO3是氧化产物 |
17.部分弱酸的电离平衡常数如下表:
下列选项错误的是( )
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25°C)) | Ki=1.77×10-4 | Ki=4.9×10-18 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A. | CN-+H2O+CO2→HCN+HCO3- | |
| B. | 2HCOOH+CO32-→2HCOO-+H2O+CO2↑ | |
| C. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者 | |
| D. | 等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者 |