题目内容
14.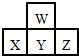 如图是周期表中短周期的一部分.若X原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )
如图是周期表中短周期的一部分.若X原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )| A. | 原子半径的大小顺序是Z>Y>X>W | |
| B. | Z的气态氢化物比X的气态氢化物稳定 | |
| C. | X、Y、Z各元素最高价和最低价的绝对值之和为8 | |
| D. | X、Y、Z最高价氧化物对应水化物的酸性强弱关系Z>Y>X |
分析 图是周期表中短周期的一部分,则X位于第三周期,X原子最外层电子数比次外层电子数少3,推知X为P,则W、Y、Z依次为O、S、Cl,根据元素周期律的递变规律判断元素的非金属性、原子半径以及对应化合物的性质.
解答 解:图是周期表中短周期的一部分,则X位于第三周期,X原子最外层电子数比次外层电子数少3,推知X为P,则W、Y、Z依次为O、S、Cl,则
A.同周期元素从左到右原子半径逐渐减小,同主族元素原子半径从上到下逐渐增大,则原子半径X>Y>Z>W,故A错误;
B.周期表中,同周期元素从左到右元素的非金属性逐渐增强,则非金属性Y>X,可知Z的氢化物比X的氢化物稳定,故B正确;
C.X、Y、Z各元素最高正价分别为+5、+6、+7,最低负价分别为-3、-2、-1,化合价的绝对值的和均为8,故C正确;
D.同周期元素从左到右元素的非金属性逐渐增强,对应的最高价氧化物对应水化物的酸性逐渐增强,则X、Y、Z最高价氧化物对应水化物的酸性强弱关系Z>Y>X,故D正确;
故选A.
点评 本题考查位置结构性质的相互关系应用,为高频考点,把握短周期及元素的位置,X为P为解答的关键,注意周期律的递变规律及分子中各原子最外层电子数的判断,侧重分析与应用能力的考查,题目难度中等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
4.下列事实的解释合理且表达正确的是( )
| A. | NH4Cl溶液呈酸性:NH4++2H2O?NH3•H2O+H3O+ | |
| B. | 氨气溶于水,溶液呈碱性:NH3•H2O═NH4++OH- | |
| C. | NaHSO4溶液可以导电:NaHSO4?Na++H++SO42- | |
| D. | 常温下,饱和H2CO3溶液pH=4:H2CO3?2H++CO32- |
5.下列说法正确的是( )
| A. | 在合成氨工业中,移走NH3可增大正反应速率,提高原料转化率 | |
| B. | 锅炉中沉积的CaSO4可用饱和碳酸钠溶液浸泡,再用盐酸溶解而除去 | |
| C. | 将AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 | |
| D. | 加热Fe2(SO4)3溶液,Fe3+的水解程度和溶液的pH均增大 |
2.下列分子中,含有两个π键的是( )
①CN- ②H2O ③CO2④H2O2⑤C2H4⑥C2H2.
①CN- ②H2O ③CO2④H2O2⑤C2H4⑥C2H2.
| A. | ①②③⑥ | B. | ③④⑤⑥ | C. | ①③⑥ | D. | ③⑤⑥ |
6.化学与生产、生活密切相关,下列叙述正确的是( )
| A. | 六水氯化钙属于混合物 | B. | 葡萄糖注射液不能产生丁达尔效应 | ||
| C. | 食盐水属于浊液 | D. | 氯化铵不属于盐类 |
17.X、Y是短周期元素,两者组成化学式为X2Y2的化合物,已知X的原子序数为n,则Y的原子序数可能是( )
(1)n+3(2)n-3(3)n+5(4)n-5(5)n+11.
(1)n+3(2)n-3(3)n+5(4)n-5(5)n+11.
| A. | (1)(2)(3) | B. | (2)(4) | C. | (1)(4)(5) | D. | 全部 |
 .从酯的性质看,油脂A在酸性条件下和碱性条件下均能发生水解,水解的共同产物是
.从酯的性质看,油脂A在酸性条件下和碱性条件下均能发生水解,水解的共同产物是 (写结构简式).
(写结构简式).
 ,反应类型是加聚反应;
,反应类型是加聚反应; ,其核磁共振氢谱的峰面积比是1:2(或2:1).
,其核磁共振氢谱的峰面积比是1:2(或2:1).