题目内容
18.a mol FeS与b mol FeO投入到V L、c mol/L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④Vc-9a+b/3)mol.
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
分析 分情况讨论:
1)当硝酸恰好反应时,生成硝酸铁的硝酸就是未被还原的硝酸,根据铁离子的物质的量计算未被还原的硝酸的物质的量即可;
2)当硝酸过量时,除去生成一氧化氮的硝酸就是未被还原的硝酸,根据氧化还原反应中得失电子守恒计算被还原的硝酸,硝酸总量-被还原的硝酸=未被还原的硝酸.
解答 解:1)当硝酸恰好反应时,amolFeS与bmolFeO被氧化生成Fe(NO3)3,根据铁原子守恒找出铁原子和硝酸的关系式:
amolFeS+bmolFeO→(amol+bmol)Fe→(amol+bmol)Fe(NO3)3→3(amol+bmol)HNO3,所以未被还原的硝酸的质量=3(amol+bmol)×63g/mol=(a+b)×189g,故②正确;
2)当硝酸过量时,amolFeS与bmolFeO生成Fe(NO3)3和H2SO4失去的电子数=amol[(3-2)+(6-(-2))]+bmol(3-2)=(9a+b)mol,氧化还原反应中得失电子数相等,所以硝酸得到(9a+b)mol电子生成一氧化氮,一个硝酸分子得到3个电子生成NO,所以被还原的硝酸的物质的量=$\frac{9a+b}{3}$mol,未被还原的硝酸的物质的量=(Vc-$\frac{9a+b}{3}$)mol,故④正确;
故选D.
点评 本题考查学生氧化还原反应原理的应用,难度中等,要求学生要有扎实的基础知识和灵活运用知识解决问题的能力,注意基础知识的全面掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.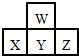 如图是周期表中短周期的一部分.若X原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )
如图是周期表中短周期的一部分.若X原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )
 如图是周期表中短周期的一部分.若X原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )
如图是周期表中短周期的一部分.若X原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )| A. | 原子半径的大小顺序是Z>Y>X>W | |
| B. | Z的气态氢化物比X的气态氢化物稳定 | |
| C. | X、Y、Z各元素最高价和最低价的绝对值之和为8 | |
| D. | X、Y、Z最高价氧化物对应水化物的酸性强弱关系Z>Y>X |
6.在下列溶液中,能大量共存的一组离子是( )
| A. | pH=1的溶液中,NH4+、Fe3+、SO42-、Cl- | |
| B. | 通入过量SO2气体的溶液中:Fe3+、NO3-、Ba2+、H+ | |
| C. | c(Al3+)=0.1mol/L的溶液中:Na+、K+、AlO2-、SO42- | |
| D. | 由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、HCO3-、Cl-、Br- |
3.正确掌握化学用语和化学基本概念是学好化学的基础.下列有关表述中正确的一组是( )
| A. | 16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体 | |
| B. | SiH4、PH3、HCl的稳定性逐渐增强 | |
| C. | 乙烯的结构简式CH2CH2 | |
| D. | Ca2+的结构示意图为 NH4Cl的电子式为 NH4Cl的电子式为  |
7.将纯锌片和纯铜片按如图所示方式插入同浓度的稀硫酸中,以下叙述正确的是( )


| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 甲、乙中SO${\;}_{4}^{2-}$都向铜片移动 | D. | 产生气泡的速率甲中比乙中快 |
8.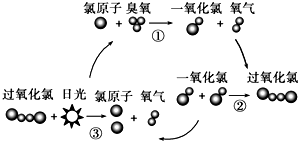 保罗•克拉兹等三位科学家因在氟利昂和臭氧层方面的工作获得诺贝尔化学奖,他们的研究揭示了大气中臭氧层被破坏的机理,如图所示.下列说法不正确的是( )
保罗•克拉兹等三位科学家因在氟利昂和臭氧层方面的工作获得诺贝尔化学奖,他们的研究揭示了大气中臭氧层被破坏的机理,如图所示.下列说法不正确的是( )
 保罗•克拉兹等三位科学家因在氟利昂和臭氧层方面的工作获得诺贝尔化学奖,他们的研究揭示了大气中臭氧层被破坏的机理,如图所示.下列说法不正确的是( )
保罗•克拉兹等三位科学家因在氟利昂和臭氧层方面的工作获得诺贝尔化学奖,他们的研究揭示了大气中臭氧层被破坏的机理,如图所示.下列说法不正确的是( )| A. | 氯原子在反应中作催化剂 | |
| B. | 过氧化氯的结构式为:O-Cl-Cl-O | |
| C. | 臭氧分子最终转变成氧气分子 | |
| D. | 过程②中一氧化氯断键形成过氧化氯 |
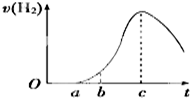 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示.
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示. 或
或 .
.