题目内容
(1)下列五组物质,每组中有一种物质从某种分类法的角度分析与其他四种不同,请找出该物质,并说明理由.[例如Fe、S、C、P:Fe(金属)]
①CuSO4、Fe(NO3)3、KMnO4、K2CO3 ;
②AgCl、BaSO4、KNO3、Ca(ClO)2 .
这种分类法是 .
(2)乙醇钠(C2H5ONa)能溶于乙醇,将乙醇钠固体从其乙醇溶液中提取出来的方法是 ;除去KNO3溶液中的I2杂质,主要操作步骤是 .
(3)配制浓度为1:5(98%的浓硫酸和水的体积比)的稀硫酸,需要用到的玻璃仪器有 .
(4)臭氧与碘化钾溶液反应的化学方程式为:O3+2KI+H2O═O2+2KOH+I2
其中还原产物与氧化产物物质的量之比是 ,若有0.5mol氧气生成,电子转移总数为 .
①CuSO4、Fe(NO3)3、KMnO4、K2CO3
②AgCl、BaSO4、KNO3、Ca(ClO)2
这种分类法是
(2)乙醇钠(C2H5ONa)能溶于乙醇,将乙醇钠固体从其乙醇溶液中提取出来的方法是
(3)配制浓度为1:5(98%的浓硫酸和水的体积比)的稀硫酸,需要用到的玻璃仪器有
(4)臭氧与碘化钾溶液反应的化学方程式为:O3+2KI+H2O═O2+2KOH+I2
其中还原产物与氧化产物物质的量之比是
考点:酸、碱、盐、氧化物的概念及其相互联系,氧化还原反应的计算,溶液的配制,物质的分离、提纯和除杂
专题:
分析:(1)①CuSO4、Fe(NO3)3、KMnO4溶液有色,K2CO3溶液无色;
②盐可以根据阴离子是含氧酸根还是无氧酸根,盐可以分为:含氧酸盐和无氧酸根;
物质的分类方法有交叉分类法和树状分类法;
(2)分离可溶性溶质,用蒸发结晶的方法;I2在有机溶剂中的溶解度大于在水溶液中的溶解度;
(3)根据粗略配制一定浓度的溶液来分析所需的仪器;
(4)氧化物被还原,得还原产物,还原剂被氧化,得氧化产物,据反应分析出两者的物质的量之比;根据反应分析出转移电子的数目和生成氧气的关系.
②盐可以根据阴离子是含氧酸根还是无氧酸根,盐可以分为:含氧酸盐和无氧酸根;
物质的分类方法有交叉分类法和树状分类法;
(2)分离可溶性溶质,用蒸发结晶的方法;I2在有机溶剂中的溶解度大于在水溶液中的溶解度;
(3)根据粗略配制一定浓度的溶液来分析所需的仪器;
(4)氧化物被还原,得还原产物,还原剂被氧化,得氧化产物,据反应分析出两者的物质的量之比;根据反应分析出转移电子的数目和生成氧气的关系.
解答:
解:(1)①CuSO4、Fe(NO3)3、KMnO4溶液有色,K2CO3溶液无色,故答案为:K2CO3(无色);
②盐可以根据阴离子是含氧酸根还是无氧酸根,盐可以分为:含氧酸盐和无氧酸盐,BaSO4、KNO3、Ca(ClO)2为含氧酸盐,AgCl是无氧酸盐,故答案为:AgCl(无氧酸盐);
此分类方法是交叉分类法,故答案为:交叉分类法;
(2)分离可溶性溶质,用蒸发结晶的方法;I2在有机溶剂中的溶解度大于在水溶液中的溶解度,故可以用CCl4来萃取出碘,步骤是加CCl4,然后分液,
故答案为:蒸发结晶;加CCl4分液;
(3)粗略配制一定浓度的溶液,只需用量筒量取一定98%的浓硫酸沿烧杯内壁注入水中,用玻璃棒搅拌,故所需的仪器有:量筒、烧杯、玻璃棒,
故答案为:量筒、烧杯、玻璃棒;
(4)氧化物被还原,得还原产物,故还原产物为KOH,在反应中的2molKOH 其中有1mol是被还原得到的,故还原产物是1mol;还原剂被氧化,得氧化产物,故氧化产物为I2,反应中氧化产物为1mol,故两者的物质的量之比为1:1;此反应转移2mol电子,生成1mol氧气,故若有0.5mol氧气生成,转移1mol电子,个数为NA个,
故答案为:1:1,NA.
②盐可以根据阴离子是含氧酸根还是无氧酸根,盐可以分为:含氧酸盐和无氧酸盐,BaSO4、KNO3、Ca(ClO)2为含氧酸盐,AgCl是无氧酸盐,故答案为:AgCl(无氧酸盐);
此分类方法是交叉分类法,故答案为:交叉分类法;
(2)分离可溶性溶质,用蒸发结晶的方法;I2在有机溶剂中的溶解度大于在水溶液中的溶解度,故可以用CCl4来萃取出碘,步骤是加CCl4,然后分液,
故答案为:蒸发结晶;加CCl4分液;
(3)粗略配制一定浓度的溶液,只需用量筒量取一定98%的浓硫酸沿烧杯内壁注入水中,用玻璃棒搅拌,故所需的仪器有:量筒、烧杯、玻璃棒,
故答案为:量筒、烧杯、玻璃棒;
(4)氧化物被还原,得还原产物,故还原产物为KOH,在反应中的2molKOH 其中有1mol是被还原得到的,故还原产物是1mol;还原剂被氧化,得氧化产物,故氧化产物为I2,反应中氧化产物为1mol,故两者的物质的量之比为1:1;此反应转移2mol电子,生成1mol氧气,故若有0.5mol氧气生成,转移1mol电子,个数为NA个,
故答案为:1:1,NA.
点评:本题考查了物质的分类方法和物质的提纯,以及氧化还原反应中氧化剂和氧化剂的判断,难度不大.

练习册系列答案
相关题目
下列做法正确的是( )
| A、金属钠着火时,用大量水进行灭火 |
| B、铝制餐具可代替铁制餐具长时间存放酸性、碱性食物 |
| C、在50mL量筒中配制0.1mol?L-1碳酸钠溶液 |
| D、易燃、易爆药品与有强氧化性的物质要分开放置并远离火源 |
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A、标准状况下,11.2L乙醇含有的分子数为0.5NA |
| B、常温常压下,22 g CO2含有的原子数为1.5NA |
| C、12 g 金属镁变成镁离子时失去的电子数为0.5NA |
| D、0.1mol?L-1Na2SO4溶液中含有的钠离子数为0.2NA |
某溶液中仅有5种离子,其中含有4n个Na+,2n个K+,n个Cu2+离子,3n个SO42-,则溶液中NO3-的个数为( )
| A、n | B、2n | C、3n | D、4n |
1.9g AO32-中核外电子数比质子数多3.01×1022个,则元素A的相对原子质量为( )
| A、12 | B、28 | C、32 | D、76 |
在醋酸中存在电离平衡:CH3COOH?CH3COO-+H+,要使溶液中的c(CH3COO-)提高,应采取的措施是( )
| A、加水 |
| B、加热 |
| C、加CH3COONa固体 |
| D、加很稀的NaOH溶液 |
 浙江省“五水共治”是水质治理的重要举措,其中化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度.COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量.某学习小组用重铬酸钾法测定某水样中的COD.主要的实验装置、仪器及具体操作步骤如下:实验装置及仪器:
浙江省“五水共治”是水质治理的重要举措,其中化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度.COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量.某学习小组用重铬酸钾法测定某水样中的COD.主要的实验装置、仪器及具体操作步骤如下:实验装置及仪器: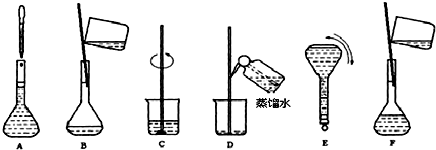
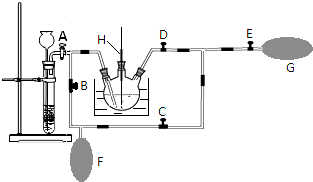 高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH