题目内容
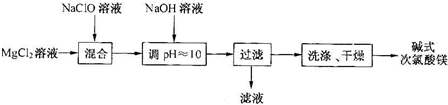
向MgCl2,AlCl3,盐酸,NH4+混合溶液中滴加NaOH至过量的现象是 ,涉及到的化学方程式有 ,以及反应的先后顺序 ,图象变化情况 .
考点:镁、铝的重要化合物
专题:元素及其化合物
分析:向MgCl2,AlCl3,盐酸,NH4+混合溶液中滴加NaOH至过量,开始时盐酸与氢氧化钠反应生成氯化钠和水,所以没有沉淀生成,盐酸反应完全后开始生成氢氧化铝、氢氧化镁沉淀,沉淀完全后铵根离子与与氢氧化钠反应,沉淀暂时不变,当铵根离子反应完全后氢氧化钠与氢氧化铝沉淀反应,则沉淀的物质的量逐渐减小,直至氢氧化铝完全溶解,此时沉淀完全为氢氧化镁,据此进行解答.
解答:
解:MgCl2、AlCl3、盐酸、NH4+混合溶液中滴加NaOH至过量,盐酸中氢离子结合氢氧根离子能力最强,所以盐酸优先反应,反应的离子方程式为:HCl+NaOH=NaCl+H2O;
当盐酸反应完全后,铝离子与镁离子开始生成沉淀,反应的化学方程式为:AlCl3+3NaOH=Al(OH)3↓+3NaCl、MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
当沉淀完全后,铵根离子结合氢氧根能力大于氢氧化铝,所以氢氧化铝溶解前,铵根离子优先与氢氧化钠反应,反应的离子方程式为:NH4++OH-=NH3?H2O;
当铵根离子反应完全,氢氧化铝开始溶解,反应的化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O,
所以滴加氢氧化钠溶液的过程中,反应现象为:开始没有沉淀,之后开始生成沉淀直至沉淀的量最大,然后沉淀的量不变,最后部分沉淀溶解;
反应的先后顺序为:盐酸、AlCl3、MgCl2、NH4+、Al(OH)3;
生成沉淀与加入氢氧化钠的物质的量关系的大致图象为: ,
,
故答案为:开始没有沉淀,之后开始生成沉淀直至沉淀的量最大,然后沉淀的量不变,最后部分沉淀溶解;HCl+NaOH=NaCl+H2O、AlCl3+3NaOH=Al(OH)3↓+3NaCl、MgCl2+2NaOH=Mg(OH)2↓+2NaCl、Al(OH)3+NaOH=NaAlO2+2H2O;盐酸、AlCl3、MgCl2、NH4+、Al(OH)3;
 .
.
当盐酸反应完全后,铝离子与镁离子开始生成沉淀,反应的化学方程式为:AlCl3+3NaOH=Al(OH)3↓+3NaCl、MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
当沉淀完全后,铵根离子结合氢氧根能力大于氢氧化铝,所以氢氧化铝溶解前,铵根离子优先与氢氧化钠反应,反应的离子方程式为:NH4++OH-=NH3?H2O;
当铵根离子反应完全,氢氧化铝开始溶解,反应的化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O,
所以滴加氢氧化钠溶液的过程中,反应现象为:开始没有沉淀,之后开始生成沉淀直至沉淀的量最大,然后沉淀的量不变,最后部分沉淀溶解;
反应的先后顺序为:盐酸、AlCl3、MgCl2、NH4+、Al(OH)3;
生成沉淀与加入氢氧化钠的物质的量关系的大致图象为:
 ,
,故答案为:开始没有沉淀,之后开始生成沉淀直至沉淀的量最大,然后沉淀的量不变,最后部分沉淀溶解;HCl+NaOH=NaCl+H2O、AlCl3+3NaOH=Al(OH)3↓+3NaCl、MgCl2+2NaOH=Mg(OH)2↓+2NaCl、Al(OH)3+NaOH=NaAlO2+2H2O;盐酸、AlCl3、MgCl2、NH4+、Al(OH)3;
 .
.
点评:本题考查了镁、铝化合物的性质,题目难度中等,明确镁离子、铝离子、氢离子、铵根离子与氢氧化钠反应的先后顺序为解答关键,试题侧重考查学生的分析、理解能力及灵活应用所学知识解决实际问题的能力.

练习册系列答案
相关题目
在加热条件下,过量铁与浓硝酸发生反应的化学方程式为:Fe+4HNO3(浓)
Fe(NO3)2+2NO2↑+2H2O下列有关该反应的说法中,正确的是( )
| ||
| A、浓HNO3是还原剂,NO2是还原产物 |
| B、氧化性:浓HNO3>Fe(NO3)2 |
| C、氧化剂与还原剂的物质的量之比为4:1 |
| D、若反应产生了0.1mol NO2,转移的电子数为0.2NA |
深秋雨后的清晨,我们常会遇到大雾天气,雾中小液滴直径范围是( )
| A、小于1 nm |
| B、在1~100 nm间 |
| C、大于100 nm |
| D、无法确定 |
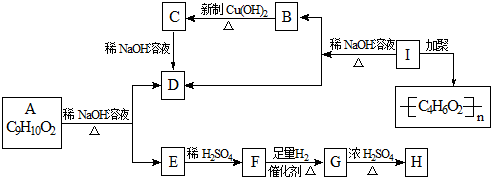
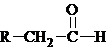 .化学式为C9H10O2的有机物A有如下的转化关系:
.化学式为C9H10O2的有机物A有如下的转化关系: